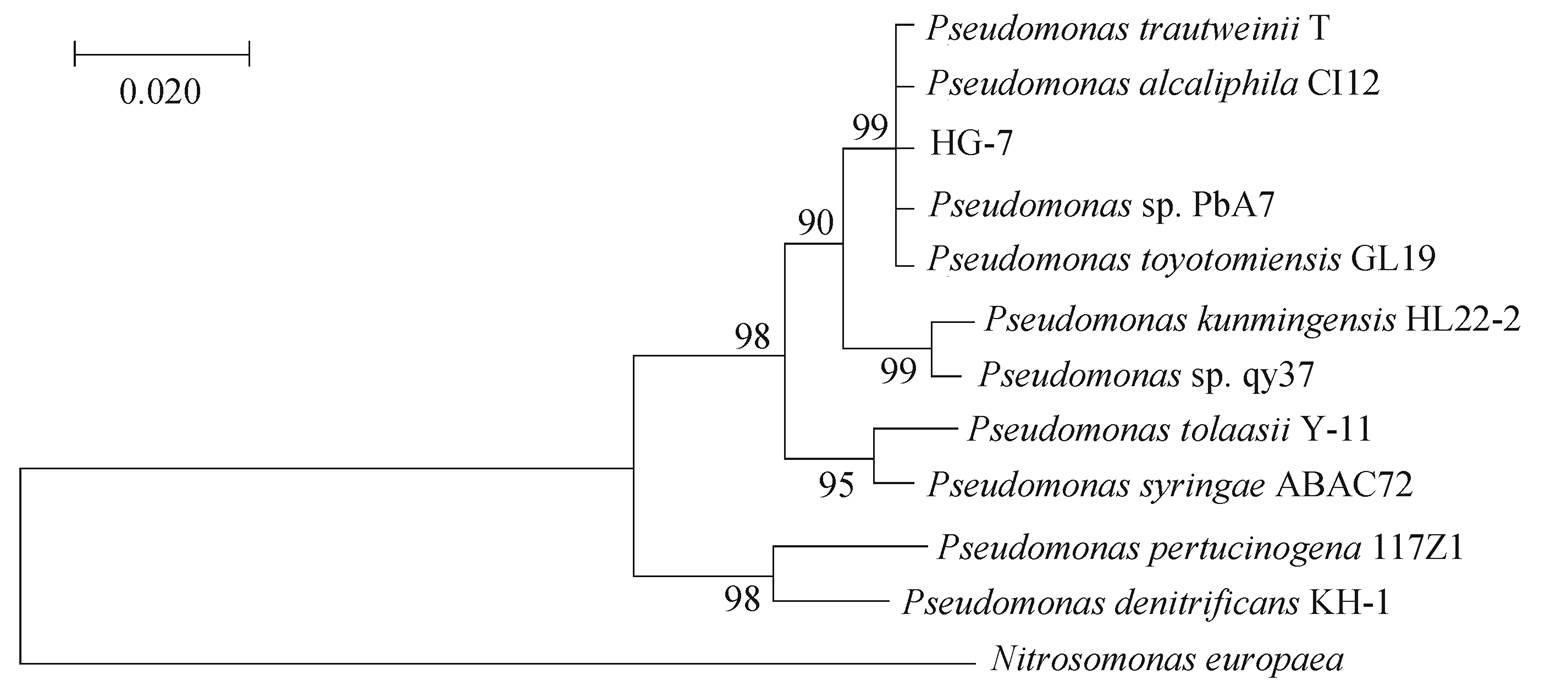
图1 基于16S rRNA同源序列构建的菌株HG-7的系统发育树
Fig. 1 Phylogenetic tree of strain HG-7 based on 16S rRNA sequences homology
李雪1刘思彤2陈倩2,†
1.兰州城市学院化学与环境工程学院, 兰州 730070; 2.北京大学环境工程系, 北京市新型污水深度处理工程技术研究中心, 北京 100871; †通信作者, E-mail: qianchen@pku.edu.cn
摘要以筛选分离得到的好氧反硝化菌HG-7为研究对象, 经过16S rRNA同源性分析, 初步鉴定该菌株为假单胞菌属(Pseudomonassp.)。对菌株HG-7反硝化功能基因的扩增结果表明, 菌体HG-7内存在好氧反硝化功能基因napA和nirK, 证实该细菌为好氧反硝化细菌。对菌株的脱氮特性和影响因素的研究表明, 以硝酸盐氮为氮源时, 菌株的最适碳源为乙酸钠和丁二酸钠, 最佳C/N比为6~10, 最适宜的温度范围为26~30℃。在上述条件下, 菌株HG-7的好氧反硝化活性较高, 48小时内对100mg/L硝酸盐氮的去除率可达98%, 且在反应过程中亚硝酸盐氮积累量较低。以亚硝酸氮为唯一氮源时, 低浓度条件下可实现100%的氮素去除率; 高浓度条件下, 脱氮速率则受到明显的抑制, 对91.4mg/L的亚硝酸盐氮氮去除率约为40%。因此, 将该菌株应用于废水的脱氮处理, 可实现氮素的有效去除, 具有潜在的应用价值。
关键词好氧反硝化菌; 鉴定; 脱氮特性
生物脱氮是去除水体中氮素污染的主要途径。传统的生物脱氮包括好氧硝化和缺氧反硝化两个过程。硝化作用是硝化细菌在好氧条件下, 以无机碳为碳源, 将氨氮转化为亚硝酸盐氮或硝酸盐氮的过程。反硝化作用是反硝化菌在缺氧条件下, 将亚硝酸盐氮或硝酸盐氮还原为含氮气体的过程。参与硝化和反硝化的微生物作用机制的差异, 导致硝化与反硝化过程存在不可避免的矛盾: 硝化需要长泥龄的硝化细菌和好氧条件, 反硝化需要短泥龄的反硝化菌和缺氧条件。这些固有的矛盾成为制约生物脱氮工艺发展的瓶颈。
随着脱氮理论研究的不断深入, 好氧反硝化作用的发现突破了对传统理论的认识。目前, 已经发现的好氧反硝化细菌有克雷柏氏杆菌属(Klebsie-lla)[1–2]、不动杆菌属(Acinetobacter)[3–4]、假单胞菌属(Pseudomonas)[5]、根瘤菌属(Rhizobium)[6]和芽孢杆菌属(Bacillus)[7]等, 这些细菌都表现出较强的好氧反硝化性能。好氧反硝化细菌的发现使得氨化、硝化和反硝化反应在好氧条件下同时进行成为可能, 实现了硝化和反硝化过程的统一, 解决了硝化细菌和反硝化细菌的矛盾。因好氧反硝化细菌在氮循环和生物脱氮领域的潜在价值, 许多生物学家和环境保护领域的学者从不同的角度开展了大量的研究。
好氧反硝化细菌属于单细胞微生物, 其生长和代谢过程易受到C/N比、温度、溶解氧浓度以及有机碳源类型等因素的影响[8]。其中, C/N比和有机碳源类型的影响最显著。此外, 在不同环境条件下, 不同种类的好氧反硝化菌表现出的反硝化特性差异较大, 需要进一步研究其作用机制和影响因素。本研究以实验室筛选得到的一株反硝化菌为研究对象, 通过16S rRNA同源性分析, 进行菌种鉴定, 探讨碳源、C/N和温度对该菌株生长及其脱氮性能的影响, 以期为生物脱氮提供良好的菌源, 并为该菌种将来的研究和应用提供实验基础和理论支持。
从生活污水处理反应器中分离纯化的好氧反硝化菌株, 编号为HG-7。
硝酸盐培养基:NaNO30.61g, CH3COONa 2.16 g, K2HPO4·3H2O 1.76 g, MgSO4·7H2O 0.20 g, CaCl20.02 g, FeSO4·7H2O 0.005 g, 水1 L。培养基的pH值调节到7.2, 121ºC灭菌30分钟。
亚硝酸盐培养基: NaNO20.24 g, CH3COONa 1.08g, K2HPO4·3H2O1.76g, MgSO4·7H2O0.20g, CaCl20.02 g, FeSO4·7H2O 0.005 g, 水1 L。培养基pH值调节到7.2, 121ºC灭菌30分钟。研究高浓度亚硝酸盐氮条件下的处理效果时,将此培养基中的NaNO2和CH3COONa分别调整为0.48g和2.16g。
1.3.1 菌株的16S rRNA的鉴定
将目的菌株平板划线活化后, 稀释涂布至反硝化培养基平板, 观察菌落形态特征。利用DNA提取试剂盒提取细菌DNA, 送交上海美吉生物技术服务有限公司进行测序, 测序结果在NCBI中进行Blast分析, 搜索序列同源性, 并结合已得到验证的好氧反硝化细菌序列, 进行系统发育分析, 通过MEGA7软件, 用NJ法构建进化树(图1)。
1.3.2 菌株反硝化功能基因的PCR扩增
反硝化功能基因napA的引物V17F(5′—TGG ACVATGGGYTTYAAYC—3′)与4R(5′—ACYTCR CGHGCVGTRCCRCA—3′),nirK的引物583F(5′—TCATGGTGCTGCCGCGKGACGG—3′)与909R(5′— GAACTTGCCGGTKGCCCAGAC—3′), 由上海美吉生物技术服务有限公司合成。PCR反应体系的反应条件: 95ºC预变性15分钟; 95ºC变性10秒, 55ºC退火30秒, 72ºC延伸30秒, 进行35个循环; 最后72ºC延伸5分钟。PCR产物经琼脂糖凝胶电泳检测。

图1 基于16S rRNA同源序列构建的菌株HG-7的系统发育树
Fig. 1 Phylogenetic tree of strain HG-7 based on 16S rRNA sequences homology
本文重点探讨碳源、C/N和温度对菌株反硝化效果的影响。在各单因素影响试验中, 碳源分别为葡萄糖、丁二酸钠、乙酸钠和蔗糖; C/N比分别为2, 4, 6, 8和10; 温度分别为15, 26, 30和37ºC。固定单一影响因子, 其余条件分别为温度30ºC, pH=7.2, 碳源为乙酸钠, C/N为6, 转速为170r/min, 培养2天。每隔一定时间取样测定OD600、亚硝酸盐氮和硝酸盐氮的浓度。
菌体光密度(OD600)的测定是采用紫外分光光度计(SHIMADZU, 日本)测定600 nm波长下菌液的吸光度; 硝酸盐氮采用紫外分光光度法测定[9]; 亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法[10]测定。
对菌株HG-7测序获得16S rRNA的长度为1280 bp, 在GenBank中的登录号为MG722850。采用 BLAST (www.ncbi.nlm.nih.gov/BLAST)将菌株HG-7的16SrRNA基因序列与GenBank数据库中已知细菌的16SrRNA基因序列进行比对分析, 结果表明HG-7与多株Pseudomonassp.同源性最高, 相似度为 99%, 因此初步确定其为假单胞菌属(Pseudomonassp.)。
硝酸盐还原为亚硝酸盐的过程有两种酶的参与, 分别是膜结合硝酸盐还原酶和周质硝酸盐还原酶(NAP)。在好氧环境下, 周质硝酸盐还原酶进行反硝化作用, 常作为鉴定好氧反硝化菌的标志[3]。编码周质硝酸盐还原酶的基因包括napEDABC基因簇, 本试验扩增得到约750bp的napA基因(图2),说明菌株能够表达硝酸还原酶。
亚硝酸盐还原酶是反硝化途径的关键酶, 能将亚硝酸盐还原为一氧化氮。亚硝酸盐还原酶(NIR)分为两种: Cu型亚硝酸盐还原酶和细胞色素cd1型亚硝酸还原酶, 分别由nirK和nirS基因编码[11]。本试验扩增得到nirK基因(图2), 长度接近且小于500 bp, 未扩增到nirS基因。实验结果表明, 菌株HG-7中存在Cu型亚硝酸还原酶, 催化了反硝化的进行。NAP和NIR的成功扩增, 从另一个方面证明菌株HG-7为典型的好氧反硝化细菌。
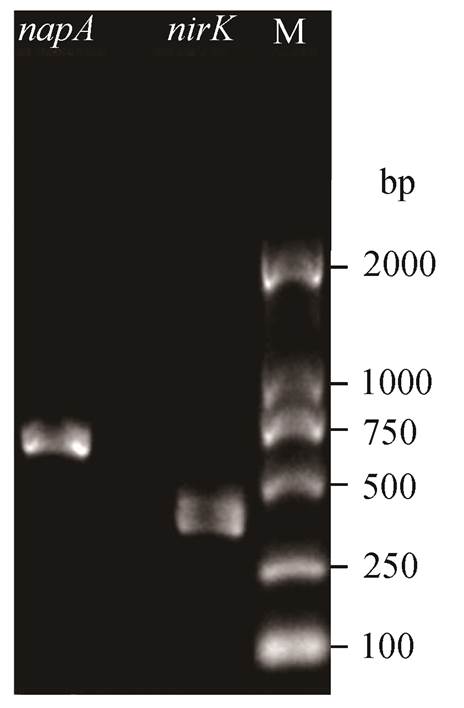
图2 HG-7功能基因napA和nirK扩增电泳图
Fig. 2 Electrophoretogram ofnapAandnirKgene of strain HG-7 by PCR amplification
2.3.1 不同碳源对菌株HG-7硝酸盐氮去除的影响
碳源主要为细菌的生长提供能量, 并作为反硝化过程的电子供体[12], 因此, 碳源的种类直接影响细菌的生长及其相关代谢活动。不同菌株对不同碳源的利用能力也不尽相同, 进而影响菌株的反硝化活性。从图3可知, 在丁二酸钠和乙酸钠作碳源的条件下, 菌株均可以很好地生长, 可在36小时达到最大生长量, 且在反硝化过程中亚硝酸盐氮积累较少。与丁二酸钠相比, 以乙酸钠为碳源时亚硝酸盐氮的积累量更少。菌株对硝酸盐氮的去除主要发生在对数生长期, 能够在48小时达到98%以上的硝酸盐氮去除率。当葡萄糖作为碳源时, 在起初12小时, 菌株处于延滞期, 之后呈指数增长, 36小时后进入稳定期。细菌生长的最大OD600值虽达到1.018, 对硝酸盐氮的去除效果却不理想, 去除率仅约33%。以蔗糖为碳源时, 菌株数量没有明显增加, 并且未发现硝酸盐氮的降解过程, 说明该菌株不能以蔗糖为唯一碳源进行生长。
反硝化是一个氧化还原反应过程, 碳源的分子结构和还原能力对脱氮效果有很大的影响[13], 并且碳源种类与菌体内周质硝酸盐还原酶的活性有很大关系[14]。菌株HG-7能利用丁二酸钠和乙酸钠很好地生长, 且对硝酸盐氮有较高的去除率, 说明小分子碳源更容易被菌体利用, 这与姜磊等[15]菌株Pseu-domonassp. N6对乙酸钠和丁二酸钠的利用率高于对大分子有机物的利用率的研究结论一致。菌株HG -7利用丁二酸钠和乙酸钠的脱氮率高于葡萄糖, 而菌株Pseudomonassp. C3利用葡萄糖和蔗糖的脱氮率高于丁二酸钠和乙酸钠[16]; 菌株Pseudomonassp.ADH-42以葡萄糖和乙酸钠为碳源时, 生长状况区别不大, 脱氮速率均约为50%[17], 都与菌株HG-7存在较大的不同。菌株HG-7不能利用蔗糖进行生长, 可能是由于蔗糖分子碳原子数较多, 导致不能被菌体利用, 这与Zheng等[18]Marinobactersp. F6完全不能利用蔗糖进行好氧反硝化的研究结论一致。由此可见, 不同好氧反硝化菌株利用碳源的能力不同, 除碳源结构外, 还与菌种种类及不同碳源在代谢中相关酶的活力有关。
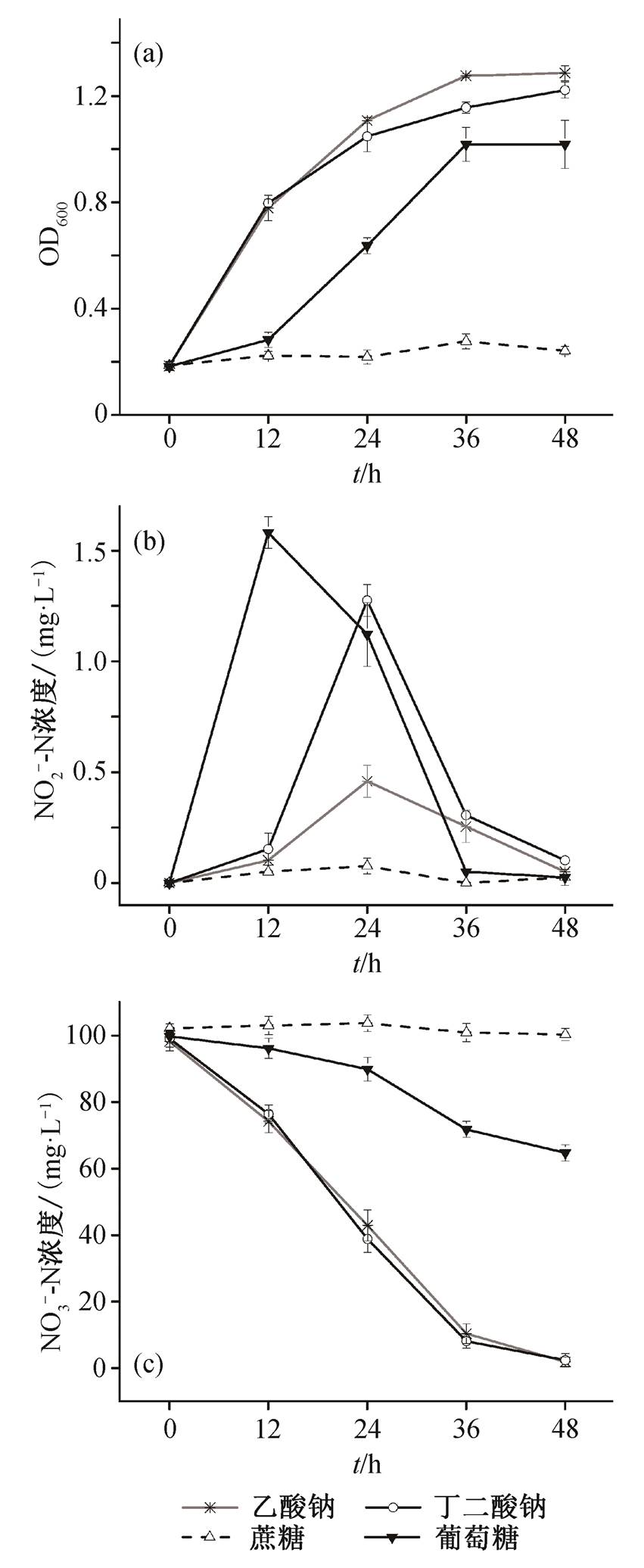
图3 不同碳源对菌株HG-7好氧反硝化的影响
Fig. 3 Effect of carbon source on the aerobic denitrification of strain HG-7
2.3.2 不同C/N比对菌株HG-7脱除硝酸盐氮的影响
有机碳源能够提供充足的能量, 供菌株生长和反硝化所需。当碳源不足时, 就没有足够的电子流提供足够的能源供菌体生长, 反硝化效率也会变低, 所以合适的C/N比对菌株正常生长非常重要。
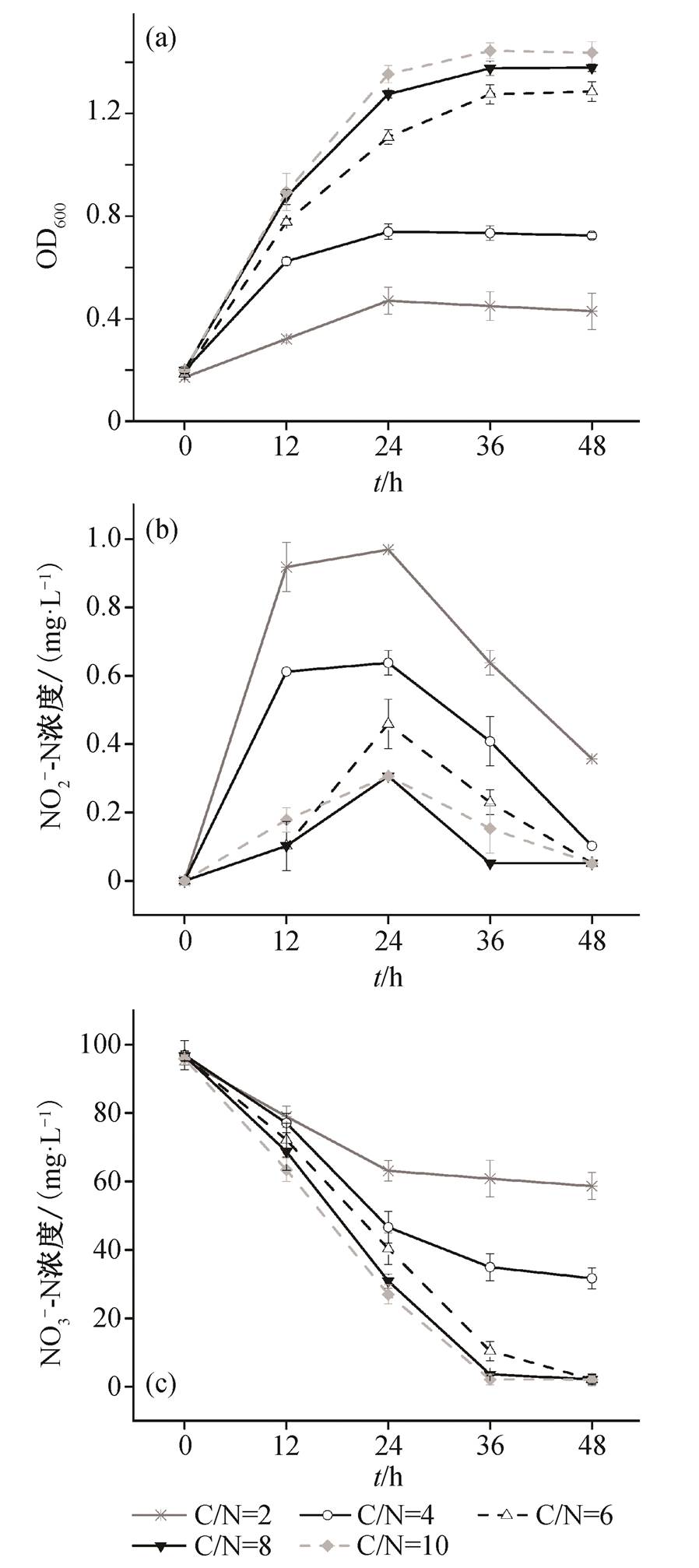
图4 不同C/N对菌株HG-7好氧反硝化的影响
Fig. 4 Effect of C/N ratio on the aerobic denitrification of strain HG-7
以乙酸钠为碳源, 固定氮源浓度, 通过调整C/N比, 分析不同C/N比条件下菌株的生长状况和对硝酸盐氮的降解效率, 结果如图4所示。可以看出, C/N比越大, 菌体生长增速越快, 亚硝酸盐氮的积累量越少。在C/N比为2的条件下, 菌株HG-7生长较慢, 在24小时达到最大OD600, 且亚硝酸盐氮的积累量相对较高。当C/N比上升至4时, 菌株HG-7的生长增快, 硝酸盐氮的去除率达到67%。C/N比继续升高到6时, 菌体生长速度和对硝酸盐氮的降解能力明显增加, 48小时能达到98%的硝酸盐氮去除率。当C/N比升高到8或10时, 菌株在24小时达到最大OD600, 且比C/N比为6时有较大幅度的增长。这可能是因为氮源和氧气都可作为菌株电子受体, 从而系统中过剩的碳源和溶解氧均可以提供电子受体, 供菌继续生长。C/N比升高到8或10时, 在36小时对硝氮的降解率达到98%以上, 说明充足的碳源使菌株生长加快, 硝酸盐氮降解速率提高。所以, 菌株在C/N比为6~10时, 对硝酸盐氮都有较好的去除速率。
菌株HG-7在任一C/N比条件下, 在12和24小时积累的亚硝氮相对较高, 48小时几乎没有亚硝酸盐积累。当C/N比为2和4时, 虽然硝酸盐氮未完全降解, 但亚硝酸盐氮积累很少, 说明菌株的亚硝酸盐还原酶不受硝酸盐氮的影响, 仍具有很强的活性。C/N比为6~10时, 菌株都具有很好的降解硝酸盐氮的效果, 可见碳源的量对菌体生长和反硝化作用至关重要。这与Pseudomonassp. C3在C/N比为6时, 脱氮率增加到94.3%, 进一步增加碳氮比, 脱氮率基本上没有变化的研究结论[19]一致, 优于Pseudo-monassp. ZD8好氧反硝化的最佳C/N比为22[20]以及Acinetobacter calcoaceticusN7最佳脱氮条件C/N比为35[21]。
2.3.3 温度对菌株HG-7脱除硝酸盐氮的影响
温度影响微生物的生长和酶促反应的进行, 是菌体反硝化作用的关键因素之一。温度比其他因素(pH、低溶解氧浓度、有毒化合物和高有机负荷等)对生物脱氮影响更显著[22], 通常过高的温度会导致菌株体内核酸或蛋白的变性, 而过低的温度会抑制酶活性, 从而降低反硝化菌的代谢活性, 导致亚硝酸盐氮还原失败。从图5可知, 15℃时, 菌株不生长, 亦没有降解硝酸盐氮的能力, 表明低温不利于菌株生长和发挥反硝化作用。26~37℃时, 菌株可以很好地生长, 并且可通过好氧反硝化作用降解硝酸盐氮。26℃时, 起初, 菌株生长较慢, 48小时内, 菌株处于对数生长期。30℃和37℃时, 能在24小时达到稳定生长期。37℃时, 12~24小时出现亚硝酸盐氮的积累, 说明菌体将NO3--N还原为NO2--N, 而亚硝酸还原酶不能及时被降解, 或高温对亚硝酸还原酶具有破坏作用, 导致NO2--N积累达到10mg/L,随后亚硝酸盐氮很快被降解。在26℃和30℃, 亚硝酸盐氮积累都较低, 且30℃时更低。低温条件下硝酸盐氮的降解速率较慢, 高温条件下硝酸盐氮降解速率更快。37℃时, 菌株能36小时将硝酸盐氮降解, 在26℃和30℃, 菌株能48小时将硝酸盐氮降解, 对硝酸盐氮的去除率达98%。因此, 在26~37℃时, 菌株都具有很好的反硝化能力, 可见菌株对温度的适宜范围较宽。为了节约能源, 实际应用中可在26~ 30℃进行硝酸盐氮的降解。
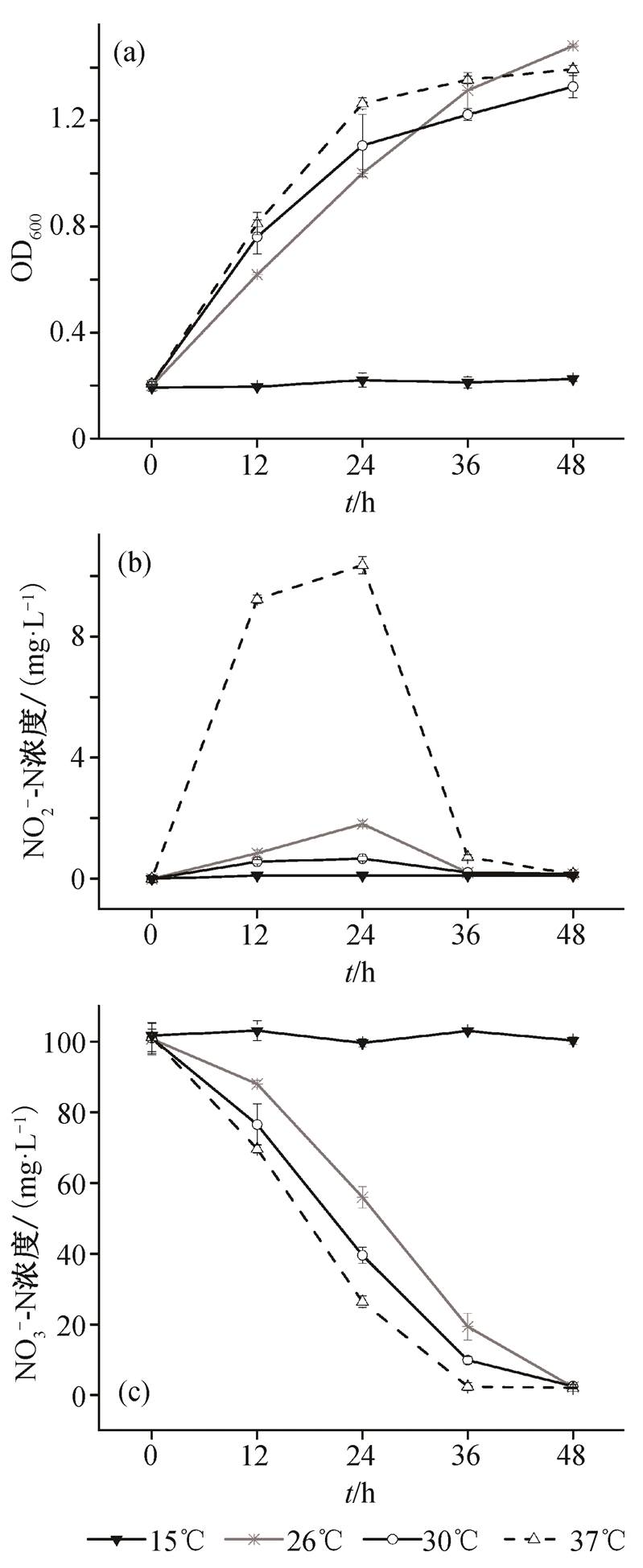
图5 温度对菌株HG-7好氧反硝化的影响
Fig. 5 Effect of temperature on the aerobic denitrification of strain HG-7
大多数反硝化菌的适宜温度都在25~37℃[23], 在此温度范围内, 菌株HG-7都能很好地生长以及降解硝酸盐氮, 而且温度越高, 菌株增殖速度越快, 脱氮速率越大, 但较高温度会加速细胞的衰亡。这与Acinetobacter juniiYB在37℃比30℃有更高的氨消除速率一致[24]。菌株HG-7在15℃不生长且没有降解硝酸盐氮的作用, 说明该菌株不耐受低温, 但有些反硝化菌能耐一定的低温, 如Acinetobactersp. HA2在10℃仍能生长和脱氮[25]。
将菌株接种在不同亚硝酸盐氮培养基上, 亚硝酸盐氮的初始浓度不同导致菌株对亚硝酸盐氮的去除能力不同。从图6看出, 当亚硝酸盐氮浓度约为91.4mg/L时, 经12小时, 亚硝酸盐氮浓度降为42.1 mg/L, 此后亚硝酸盐氮浓度趋于平衡, 24小时达到最大OD600, 但对亚硝酸盐氮的去除率却只有40%。当亚硝酸盐氮浓度较低时, 经12小时亚硝酸盐氮浓度由原来的48.1mg/L降到1.9mg/L, 对亚硝酸盐氮的去除率达到95%以上, 24小时达到最大OD600, 亚硝酸盐氮100%被去除。一方面, 可能由于较高的亚硝酸氮浓度会对菌株产生毒性, 抑制菌株的生长和代谢; 另一方面, 可能碳源不能满足较高菌体生长的需要, 导致亚硝酸盐氮不能有效地降解。通过比较发现, 同等条件下, 菌株HG-7对硝酸盐氮的脱除能力高于亚硝酸盐氮。因此, 菌株HG-7对亚硝酸盐氮具有一定的脱氮能力, 但过高的亚硝酸盐氮会抑制其活性。Bacillussp.YX-6菌株在亚硝酸盐氮浓度超过20mg/L时, 反硝化活性受到抑制[26], 与Bacillussp.YX-6相比, 本次筛选得到的菌株具有明显的优势。
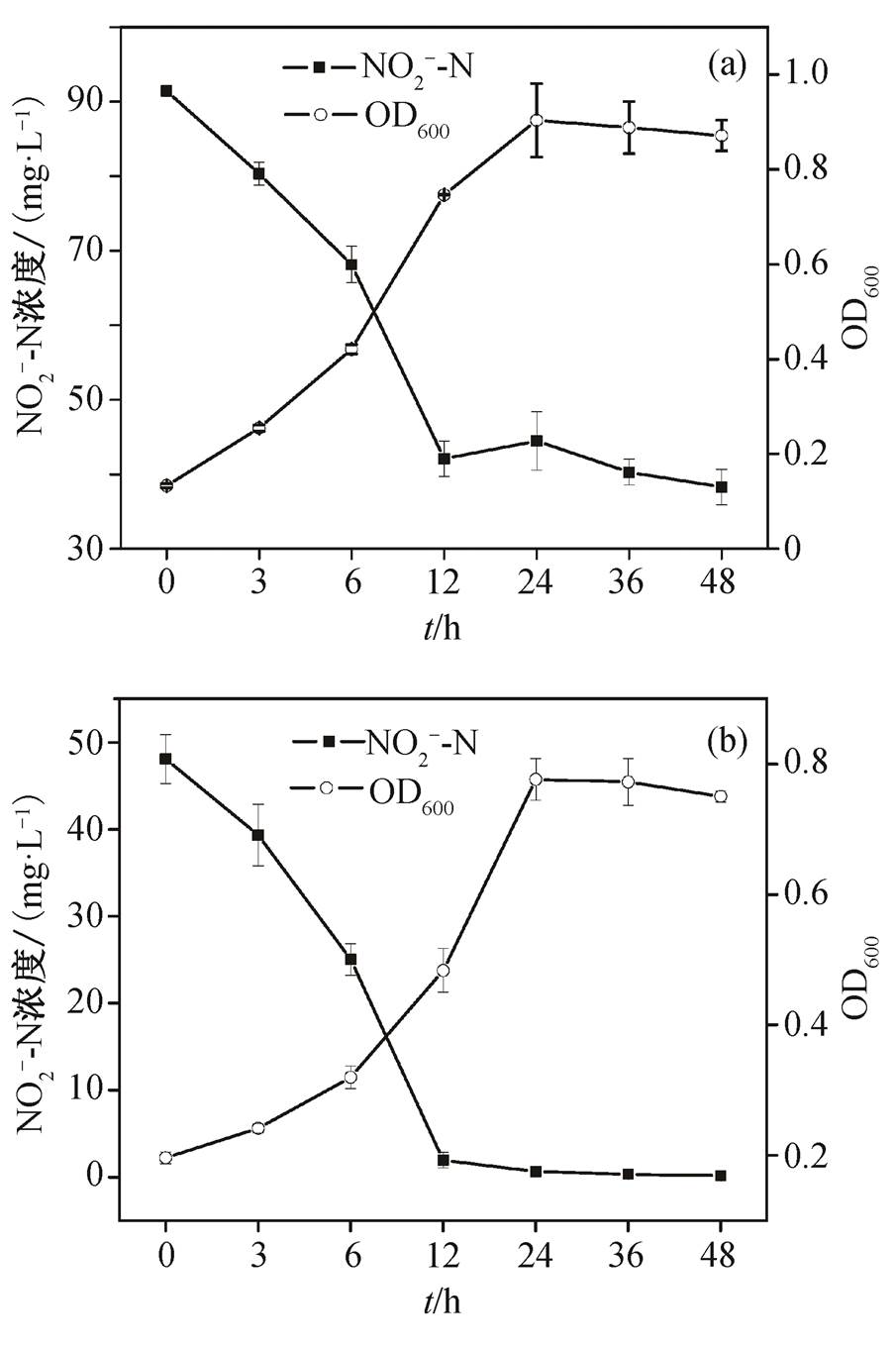
图6 菌株HG-7的亚硝酸盐反硝化过程
Fig. 6 Process of nitrite denitrification of strain HG-7
本研究筛选分离得到的好氧反硝化菌株HG-7, 经16S rRNA序列分析, 鉴定为Pseudomonassp.。通过性能测试和反硝化功能基因扩增, 确定该菌隶属于好氧反硝化细菌。本文主要结论如下。
1)以乙酸钠和丁二酸钠为碳源的脱氮效果最好, 葡萄糖次之。以蔗糖为碳源时, 菌株HG-7不能进行生长和脱氮。
2)该菌株适宜的温度范围较大, 为26~37℃。
3)在C/N比为6时, 菌株HG-7有很好的脱氮效果, 对硝酸盐氮的去除率达到98%, 且脱氮过程中亚硝氮积累量较少。
4)以亚硝酸盐氮为氮源时, 在低浓度条件(48.1 mg/L)下, 可实现亚硝酸盐100%的去除; 在高浓度条件(91.4 mg/L)下, 亚硝酸盐还原收到明显的抑制, 去除率仅为40%。
参考文献
[1]Padhi S K, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifyingKlebsiella pneumoniaeCF-S9 strain for bioremedia-tion of wastewater. International Biodeterioration & Biodegradation, 2013, 78(3): 67–73
[2]孙庆花, 于德爽, 张培玉, 等. 1株海洋异养硝化–好氧反硝化菌的分离鉴定及其脱氮特性. 环境科学, 2016, 37(2): 647–654
[3]Huang X F, Li W G, Zhang D Y, et al. Ammonium removal by a novel oligotrophicAcinetobactersp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature. Bioresource Tech-nology, 2013, 146 (10): 44–50
[4]王静, 丁国际, 林玮, 等.Acinetobacter baumanniiWJ6茵落的生长及其异养硝化一好氧反硝化特性. 净水技术, 2016, 35(1): 67–69
[5]张培玉, 曲洋, 于德爽, 等. 菌株qy37的异养硝化/好氧反硝化机制比较及氨氮加速降解特性研究. 环境科学, 2010, 31(8): 1819–1826
[6]肖继波, 江惠霞, 褚淑祎. 不同氮源下好氧反硝化菌Defluvibacter lusatiensisstr. DN7的脱氮特性. 生态学报, 2012, 32(20): 6463–6470
[7]赵惊鸿, 黄少斌. 一株耐高温好氧反硝化菌的筛选及特性研究. 环境科学与技术, 2015, 38(1): 6–10
[8]Chen Q, Ni J R. Ammonium removal byAgrobacte-riumsp. LAD9 capable of heterotrophic nitrification-aerobic denitrification. Journal of Bioscience and Bioengineering, 2012, 113(5): 619–623
[9]中华人民共和国环境保护总局. HJ/T 346-2007水质硝酸盐氮的测定紫外分光光度法(试行). 北京: 中国环境科学出版社, 2007
[10]中华人民共和国国家环境保护局. GB 7493—1987水质亚硝酸盐氮的测定分光光度法. 北京: 中国标准出版社, 1987
[11]张倩, 王弘宇, 桑稳姣, 等. 1株反硝化除磷菌的鉴定及其反硝化功能基因研究. 环境科学学报, 2013, 34(7): 2876–2881
[12]Bernat K, Wojnowska-Barya I. Carbon source in aero-bic denitrification. Biochemical Engineering Journal, 2007, 36(2): 116–122
[13]Her J J, Huang J S. Influences of carbon source and C/N ratio on nitrate/nitrate denitrificationand carbon breakthrough. Bioresource Technology, 1995, 95(54): 45–51
[14]Richardson D J, Ferguson S J. The influence of carbon substrate on the activity of the periplasmic nitrate reductase in aerobically grownThiosphaera pantotropha. Archives of Microbiology, 1992, 157(6): 535–537
[15]姜磊, 徐成斌, 马溪平, 等. 1株好氧反硝化菌的分离鉴定和反硝化特性研究. 环境科学与技术, 2013, 36(3): 12–15
[16]陈玲, 白洁, 赵阳国, 等. 分离于河口区芦苇湿地1株好氧反硝化菌的鉴定及其反硝化特性.微生物学报, 2016, 56(8): 1314–1325
[17]刘天琪, 金若菲, 周集体, 等. 异养硝化–好氧反硝化菌ADN-42的脱氮特性. 环境工程学报, 2015, 9(2): 889–996
[18]Zheng H Y, Liu Y, Gao X Y, et al.Characterization of a marine origin aerobic nitrifying-denitrifying bacterium. Journal of Bioscience & Bioengineering, 2012, 114(1): 33–37
[19]王弘宇, 马放, 苏俊峰, 等. 好氧反硝化菌株的鉴定及其反硝化特性研究. 环境科学, 2007, 28(7): 1548–1552
[20]赵丹, 于德爽, 李津, 等. 菌株ZD8的分离鉴定及其异养硝化和缺氧/好氧反硝化特性研究. 环境科学学报, 2013, 33(11): 3007–3016
[21]田雪雪, 程玉立, 张圆圆, 等. 一株异养硝化–好氧反硝化功能菌的分离鉴定及其脱氮特性. 环境工程学报, 2017, 11(2): 1269–1275
[22]Rodriguez-Caballero A, Hallin S, Pahlson C, et al. Ammonia oxidizing bacterial communitycomposition and process performance in wastewater treatment plants under low temperature conditions. Water Sci-ence&Technology, 2012, 66(2): 197–204
[23]Joo H S, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification byAlcaligenes faecalisNo. 4. Journal of Bioscience & Bioengineering, 2005, 100 (4): 184–191
[24]Ren Y X, Yang L, Liang X. The characteristics of a novel heterotropic nitrifying and aerobic denitrifying bacterium,Acinetobacter juniiYB. Bioresource Tech-nology, 2014, 171: 1–9
[25]Yao S, Ni J R, Ma T, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium,Acinetobactersp. HA2. Bioresource Technology. 2013, 139: 80–86
[26]Song Z F, An J, Fu G H, et al. Isolation and charac-terization of an aerobic denitrifying Bacillus sp. YX-6 from shrimp culture ponds. Aquaculture, 2011, 319 (1/2): 188–193
Identification of an Aerobic Denitrifier and Its Denitrification Characteristics
LI Xue1, LIU Sitong2, CHEN Qian2,†
1.School of Chemistry and Environmental Engineering, Lanzhou City University, Lanzhou 730070; 2. Beijing Engineering Research Center of Advanced Wastewater Treatment, Department of Environmental Engineering, Peking University, Beijing 100871; † Corresponding author, E-mail: qianchen@pku.edu.cn
AbstractStrain HG-7 was identified asPseudomonassp. through 16s rRNA gene sequence analysis. The aerobic denitrification ability of strain HG-7 was further proved by the existence of thenapAandnirKgenes. Further studies showed that the optimal carbon resources for strain HG-7 were sodium acetate and sodium succinate, the optimal C/N ratio was 6-10, and the suitable temperature was 26-30℃. At this condition, with an initial nitrate nitrogen of 100 mg/L, 98% of nitrate could be removed in 48 hours and the amount of nitrite accumulation was very small. Moreover, with nitrite as the sole nitrogen source, 100% of nitrite could be removed at lower nitrite concentration. But the nitrite nitrogen removal rate was about 40% when the nitrite concentration increased to 91.4 mg/L, indicating that high nitrite concentration was harmful for aerobic denitrification by strain HG-7. The strain HG-7 has great potential to be used for biological nitrogen removal, which was particularly significant for actual wastewater treatment processes.
Key wordsaerobic denitrifier; identification; nitrogen characteristics
中图分类号X172
doi:10.13209/j.0479-8023.2018.071
北京市科技专项(Z161100005016034)资助
收稿日期:2017-11-20;
修回日期:2017-12-27;
网络出版日期:2018-10-22