珠江口海水养殖区水体、沉积物及水产品中抗生素的分布
郝红珊 徐亚茹 高月 王之芬 李杰 许楠†
深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055; †通信作者, E-mail: xunan@pkusz.edu.cn
摘要采用超声波萃取结合超高效液相色谱串联质谱(UPLC-MS/MS)法, 研究珠江口(珠海和大亚湾)海水养殖区的水样、沉积物以及水产品(鱼类和贝类)中 22 种抗生素的污染状况。结果表明, 珠江口海水养殖区的主要污染物是喹诺酮类的诺氟沙星、氧氟沙星、环丙沙星和氟甲喹等。珠海沉积物和水样中抗生素污染程度略高于大亚湾。水样中抗生素的浓度范围为0.13(磺胺甲恶唑)~4.68(奇霉素)ng/L, 浓度水平受降水影响显著。沉积物中抗生素的浓度范围为0.02(金霉素)~8.77(奇霉素)ng/g(干重), 表现出时间累积性。水产品中抗生素浓度范围为0.06(磺胺甲基嘧啶) ~46.75(诺氟沙星)ng/g(干重), 贝类和鱼类样品中抗生素污染程度接近, 差异性不显著。相关性分析结果表明, 沉积物样品间的污染程度类似, 水产品样品间污染的相似性也较显著, 而不同水样间的污染成分及污染水平差异性较大。
关键词抗生素; 珠江口; 养殖区; 水体; 沉积物; 水产品
抗生素在畜牧业、水产养殖业和人类日常生活等方面的大量使用, 直接或间接地诱导细菌耐药性的不断增强[1]。抗生素在食物链中蓄积, 人类食用后, 会引起肠道功能紊乱[2], 或产生过敏反应, 有的还会引起再生性障碍贫血[3]。近年来, 我国食品(尤其是畜牧产品、水产品)和饲料中频频检出抗生素, 并且, 畜牧业和水产养殖业存在抗生素滥用现象。目前, 对珠江三角洲水产养殖区抗生素的研 究[1,4–7],多数只分析水或沉积物中一到两类抗生素的污染现状, 综合分析养殖区表层水样、沉积物和水产品中污染现状的研究较少, 且同时分析多种抗生素赋存状态的研究更少。因此, 本文拟研究珠江口海水养殖区内多类抗生素在水体、沉积物和生物各相中的存在状况, 为水产养殖业相关质量基准的制定、抗生素的有效管理和控制提供系统的理论 依据。
1 材料与方法
1.1 仪器与试剂
实验仪器包括超高效液相色谱–三重四极杆质谱系统(1290 UPLC-6460A MS/MS, Agilent, 美国)、二十四孔固相萃取装置(Supelco, 美国)、氮气吹干仪(BF-2000, 北京八方世纪公司)、冷冻离心机(200R/320R, Hettich, 德国)和溶剂过滤器(天津津腾公司)。
实验所用 22 种抗生素类目标污染物的详细信息见表 1。其中, 氟甲喹和金霉素购于加拿大 TRC公司, 氯霉素购于英国 Fluorochem 公司, 其余 19种物质均购于德国 Dr. Ehrenstorfer 公司。用于定量的内标物质有 sulfamethoxazole-d4, carbamaz epie-d9, roxithromycin-d7和ibuprofen-d3, 购于英国Cam-bridge Isotope Laboratories (CIL)公司。各标准品的纯度均高于 99%。甲醇购于 Sigma-Aldrich 公司, 乙腈购于百灵威(J&K)公司。实验所用有机溶剂为色谱纯, 其余试剂均为分析纯。
主要实验耗材 Oasis HLB(6 mL, 200 mg)和Oasis PRiME HLB(6 mL, 200 mg)固相萃取小柱购于美国Waters公司, 0.22 μm有机尼龙滤头购于上海安谱(Anpel)公司, 玻璃纤维滤膜(GF/F 0.7 μm)购于英国Whatman公司。
用甲醇配制 100mg/L 的抗生素混合标准储备液及100 mg/L的混合内标储备液, 于−20ºC冷藏备用。柠檬酸盐缓冲溶液的配置方法: 准确称量 34.7 g一水柠檬酸和 10.2g 柠檬酸三钠, 用超纯水定容至 0.5L, 搅拌至溶解后, 用 NaOH 溶液(4 mol/L) 调节pH至3, 避光保存备用。
表1 目标抗生素类物质名录[8]
Table 1 Basic information of target antibiotics[8]
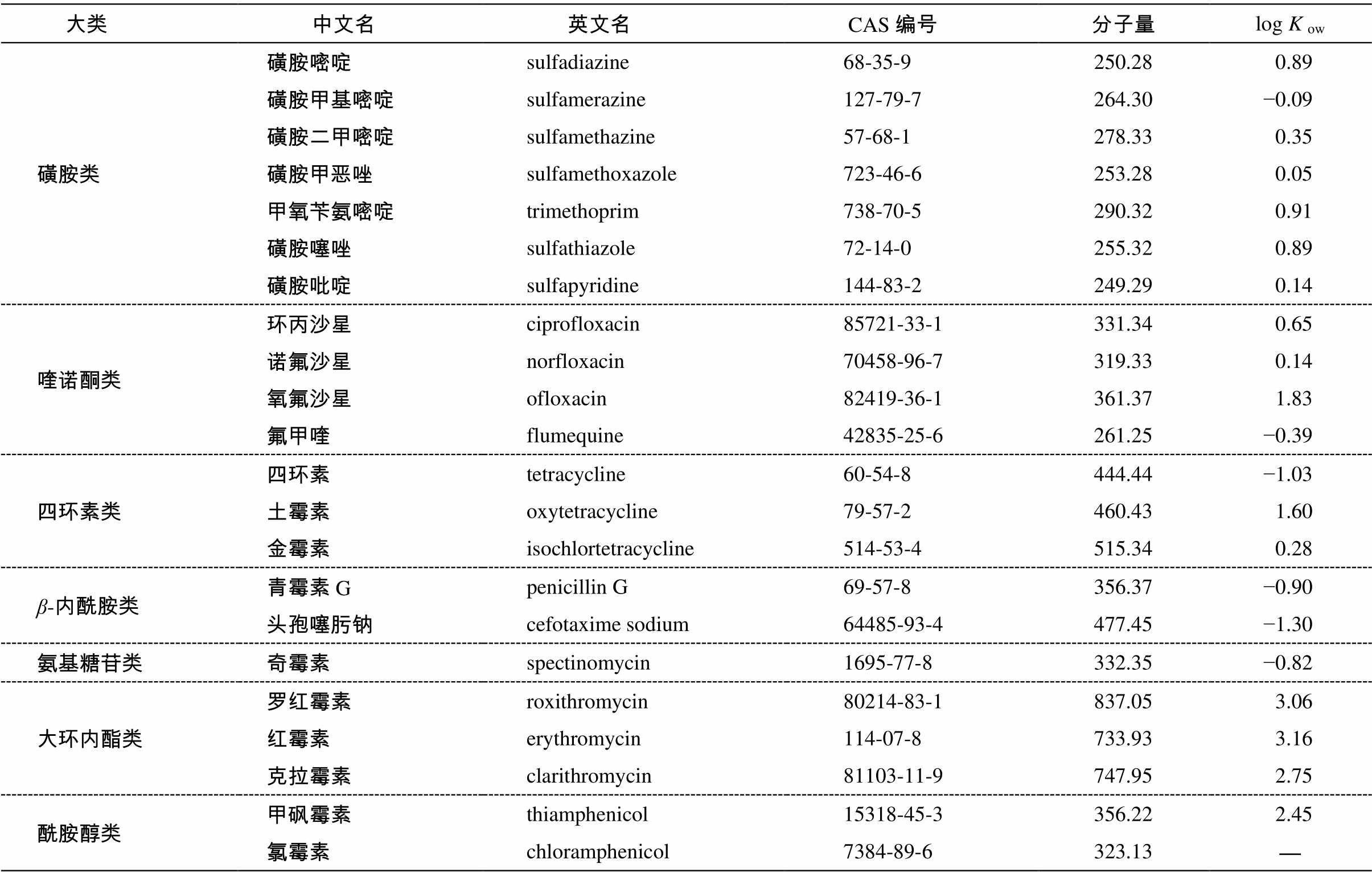
大类中文名英文名CAS编号分子量log K ow 磺胺类磺胺嘧啶sulfadiazine68-35-9250.280.89 磺胺甲基嘧啶sulfamerazine127-79-7264.30−0.09 磺胺二甲嘧啶sulfamethazine57-68-1278.330.35 磺胺甲恶唑sulfamethoxazole723-46-6253.280.05 甲氧苄氨嘧啶trimethoprim738-70-5290.320.91 磺胺噻唑sulfathiazole72-14-0255.320.89 磺胺吡啶sulfapyridine144-83-2249.290.14 喹诺酮类环丙沙星ciprofloxacin85721-33-1331.340.65 诺氟沙星norfloxacin70458-96-7319.330.14 氧氟沙星ofloxacin82419-36-1361.371.83 氟甲喹flumequine42835-25-6261.25−0.39 四环素类四环素tetracycline60-54-8444.44−1.03 土霉素oxytetracycline79-57-2460.431.60 金霉素isochlortetracycline514-53-4515.340.28 β-内酰胺类青霉素Gpenicillin G 69-57-8356.37−0.90 头孢噻肟钠cefotaxime sodium64485-93-4477.45−1.30 氨基糖苷类奇霉素spectinomycin1695-77-8332.35−0.82 大环内酯类罗红霉素roxithromycin80214-83-1837.053.06 红霉素erythromycin114-07-8733.933.16 克拉霉素clarithromycin81103-11-9747.952.75 酰胺醇类甲砜霉素thiamphenicol15318-45-3356.222.45 氯霉素chloramphenicol7384-89-6323.13—
1.2 样品采集
选取大亚湾、珠海的渔业养殖区为研究区域, 于 2014 年 10 月(秋季)和 2015 年 3 月(春季)进行采样。每个养殖区对应选取一个对照区: 养殖区 200 m 以外、周围没有人类活动的水域。2014 年 10 月也在珠海的前生蚝养殖区采样, 拟考察养殖活动停止后抗生素污染的变化。采样点信息见表2。
采集表层水样(water, WT)和表层沉积物(se-diment, SD)样品。在渔排上购买水产品, 包括养殖鱼类(青斑(Epinephelus awoara, EA)和白鲳(Ephip-pus orbis, EO))以及养殖贝类(生蚝(Ostrea gigasThunberg, OS)和贻贝(Mytilus edulis, ME))。水样盛放在棕色玻璃瓶中, 用稀硫酸调节 pH 至 3。沉积物用柱状采样器采集, 用锡纸包裹, 封入聚乙烯自封袋中。所有样品于 4ºC 低温避光保存, 24 小时内运回实验室, 以备后续处理。
1.3 样品前处理
先用玻璃纤维滤膜过滤水样。取 1L 滤液, 加入 0.5g 的 Na2EDTA, 再加入混合内标。萃取前, 分别用10 mL甲醇和10 mL超纯水活化Oasis HLB固相萃取小柱。然后, 使水样通过萃取小柱, 上样速度为 15mL/min。水样萃取完成后, 用 10mL 超纯水淋洗小柱, 真空下抽干 0.5 小时。用 10mL 甲醇洗脱至玻璃试管中, 氮气吹干, 用 1 mL 50% (体积比)的乙腈水溶液定容, 经 0.22μm 的针头式有机滤膜过滤后, 转移到进样小瓶中, −20ºC 保存待测。
沉积物冷冻干燥 48 小时(−50ºC), 研磨过 100目筛, 置于棕色瓶中保存备用。称取冻干沉积物2±0.05 g, 置于50 mL离心管中, 加入混合内标, 在通风橱中避光静置。向离心管中加入 5 mL 的柠檬酸缓冲液、5 mL 乙腈, 室温下超声波萃取20分钟, 然后 4000 rpm离心 5 分钟。重复萃取操作2次。合并3次萃取液, 加入 400 mL 超纯水, 加入 0.2g Na2EDTA, 充分搅拌。沉积物萃取液用 OasisHLB固相萃取小柱富集, 操作方法同水样。
鱼类记录鱼体长度和重量, 解剖下适量背部肌肉; 贝类记录带壳直径和带壳重量, 解剖出贝肉。取适量鱼肉、贝肉冷冻干燥 48 小时(−50ºC), 研磨, 用锡纸包裹, 于−20ºC 保存备用。生物样超声波萃取。称取0.2±0.02g冻干生物样品, 置于50 mL离心管中, 加入内标物, 于通风橱中避光静置。向离心管中加入 8mL80% (体积比) 乙腈水溶液, 室温下超声波萃取 15 分钟, 于 4500rpm离心 5 分钟。重复萃取过程一次, 合并两次萃取液, 经 Oasis PRiME HLB 柱去除杂质。净化后的萃取液在平缓的氮气中吹干, 定容过程同水样。
1.4 样品检测
用超高效液相色谱–三重四极杆质谱分析样品中的抗生素。流动相A为水, 流动相B为100%乙腈(acetonitrile, ACN)。对于负模式检测的物质, 进样量为 3μL。UPLC 梯度洗脱条件: 初始流速为0.3 mL/min, ACN初始比例为40%; 从0.5分钟到7分钟, ACN从40%匀速增至100%; 从7分钟到8分钟, ACN 从 100% 匀速降至 40%, 平衡 3 分钟。对于正模式检测的物质, 进样量为 2 μL, 初始流速为0.3mL/min, ACN 初始比例为 10%。UPLC梯度洗脱条件: 保持初始比例 6 分钟; 从 6 分钟到 24 分钟, ACN从10%匀速增至60%; 从24分钟到30分钟, ACN从60% 匀速增至100%; 从 30 分钟到 32 分钟, ACN从100%匀速降至10%, 平衡 3 分钟。质谱条件: 釆用电喷雾离子化源, 正、负离子电离模式(ESI+/ESI-), 多重反应检测方式(MRM), 气体温度为 350ºC, 流速为 12 L/min, 雾化器压力为 45 psi, 毛细管电压为−3500 V (负模式)、+4000 V (正模式), 加速电压为4 V。
表2 采样点信息汇总
Table 2 Basic information of sampling sites
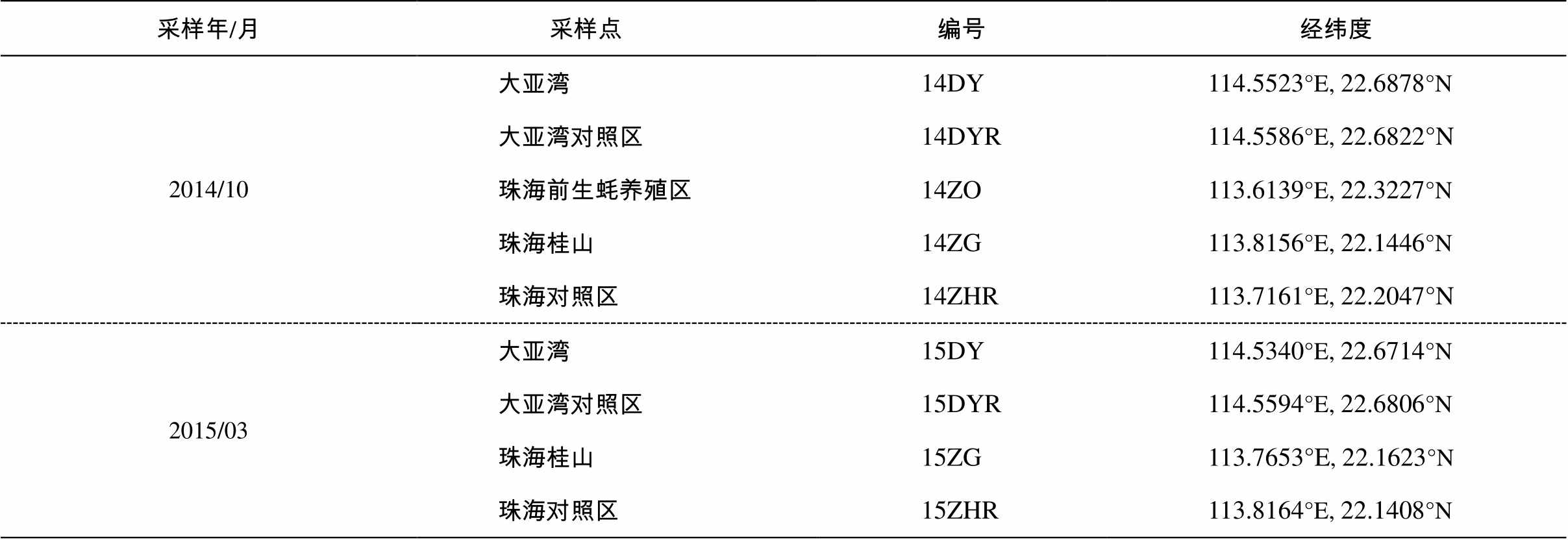
采样年/月采样点编号经纬度 2014/10大亚湾14DY114.5523°E, 22.6878°N 大亚湾对照区14DYR114.5586°E, 22.6822°N 珠海前生蚝养殖区14ZO113.6139°E, 22.3227°N 珠海桂山14ZG113.8156°E, 22.1446°N 珠海对照区14ZHR113.7161°E, 22.2047°N 2015/03大亚湾15DY114.5340°E, 22.6714°N 大亚湾对照区15DYR114.5594°E, 22.6806°N 珠海桂山15ZG113.7653°E, 22.1623°N 珠海对照区15ZHR113.8164°E, 22.1408°N
1.5 质量保证与质量控制
本方法的水样检出限(LOD)为 0.01~0.29ng/L, 定量限(LOQ)为 0.04~1.00ng/L。沉积物的 LOD 为0.005~0.15 ng/g, LOQ为0.02~0.50 ng/g。生物样的LOD为0.05~1.45 ng/g, LOQ为0.2~5.0 ng/g。水样和沉积物回收率实验中, 标准品浓度分别为 10 和100μg/L(或ng/g), 回收率范围分别为80%~127%和 58%~108%。生物样回收率实验中, 标准品浓度为20 和 200 ng/g, 回收率为60%~128%。
2 结果与讨论
2.1 水样中抗生素的污染状况
图1给出珠海和大亚湾水产养殖区水样、沉积物和水产品中抗生素的浓度分布。从图 1(a)可知, 海水水样中检出的 6 种抗生素及其均值为奇霉素(4.68ng/L)、氧氟沙星(3.19ng/L)、诺氟沙星(2.09 ng/L)、头孢噻肟钠(1.58ng/L)、甲氧苄氨嘧啶(0.54 ng/L)和磺胺甲恶唑(0.13ng/L), 检出情况与珠江口淡水养殖区[4]类似。2014年秋季水样抗生素浓度高于 2015 年春季, 珠海污染情况高于大亚湾。据广东省气象局数据, 2014年10月(秋季)的降水量少于2015 年 3 月(春季), 说明海水中抗生素的污染受降水影响显著。
图 1(a)中, 大部分水样对照区污染程度高于养殖区, 只有 14ZG(养殖区)的污染程度高于对照区, 与王敏等[9]在福建九龙江入海口养殖区的发现类似。我们推测抗生素的污染可能受水力交换、沿岸居民生活生产活动等复杂因素影响。14ZO(珠海前生蚝养殖区, 现已停止养殖活动)与 14ZHR 污染成分及污染程度相似, 并且与养殖区 14ZG 差异明显。推测生蚝养殖活动停止后, 该区域水环境中的抗生素污染程度会逐渐减轻, 直至非养殖海域污染程度, 但是该推论还需进一步证明。14ZG 中检测到大量的氧氟沙星(26.24ng/L)和少量的诺氟沙星(2.64 ng/L), 推测采样前不久加过相关渔药。
梁惜梅等[4]在珠江口淡水养殖塘水样中检出几到几十 ng/L 的诺氟沙星、氧氟沙星和四环素。王敏等[9]在福建九龙江入海口养殖区的不同养殖塘(包括鱼塘、螃蟹池、蚌池、虾池、鸭池)水体中检出浓度水平类似的抗生素, 为几到十几 ng/L, 在鸭池中检出 40.20ng/L 的甲氧苄氨嘧啶, 系养殖时渔民大量添加磺胺嘧啶与甲氧苄氨嘧啶所致。本实验结果略低于以上养殖区的污染程度, 略高于大亚湾海水养殖区2009年的浓度[6]。
本实验水体中抗生素浓度远远低于牲畜养殖场污水[10]、珠江[1,7,11]的浓度, 低于辽河[12]、海河[13]的污染程度, 与维多利亚港[1]、美国[14]、日本[15]、英国[16]的污染水平类似, 检出浓度均很低。综上所述, 本实验结果低于其他养殖区浓度, 和国内外自然水体相比污染较轻。
2.2 沉积物中抗生素的污染状况
沉积物中检出 13 种抗生素, 未检出物质大部分为磺胺类。污染均值为0.02(金霉素)~8.77(奇霉素)ng/g(干重), 主要污染物及其均值为奇霉素(8.77 ng/g)、诺氟沙星(2.54ng/g)、氧氟沙星(0.32ng/g), 其他污染物浓度均小于0.3 ng/g。沉积物中, ∑抗生素范围为7.99(15DYR)~22.73(14ZHR)ng/g。从图1(b)可知, 沉积物中抗生素污染的差异性不大, 2015年春季的污染水平小于 2014 年秋季, 珠海的污染水平略高于大亚湾。
聂湘平等[6]在大亚湾海水养殖区沉积物中未检测到恩诺沙星, 诺氟沙星和环丙沙星最高可达 8.81 ng/g, 与本实验结果类似。梁惜梅等[4]在淡水鱼塘沉积物中检出最高为 85.25 ng/g的喹诺酮类抗生素, 比本实验结果高约一个数量级。阮悦斐等[17]在天津近郊淡水养殖区沉积物中检测到 1.50~30.10ng/g的喹诺酮类、磺胺类抗生素, 高于本实验结果。有研究表明, 养殖网箱箱底沉积物中四环素残留量为2.00~6.30μg/mg[18], 远高于本实验结果。与其他河流表层沉积物相比, 本实验中甲氧苄氨嘧啶含量远远小于巴西[19], 磺胺甲恶唑的污染水平与美国[20]、加拿大[21]的研究结果类似, 均未检出。综上所述, 与其他养殖区、其他河流的沉积物相比, 珠江口海水养殖区沉积物中抗生素的污染程度较低。
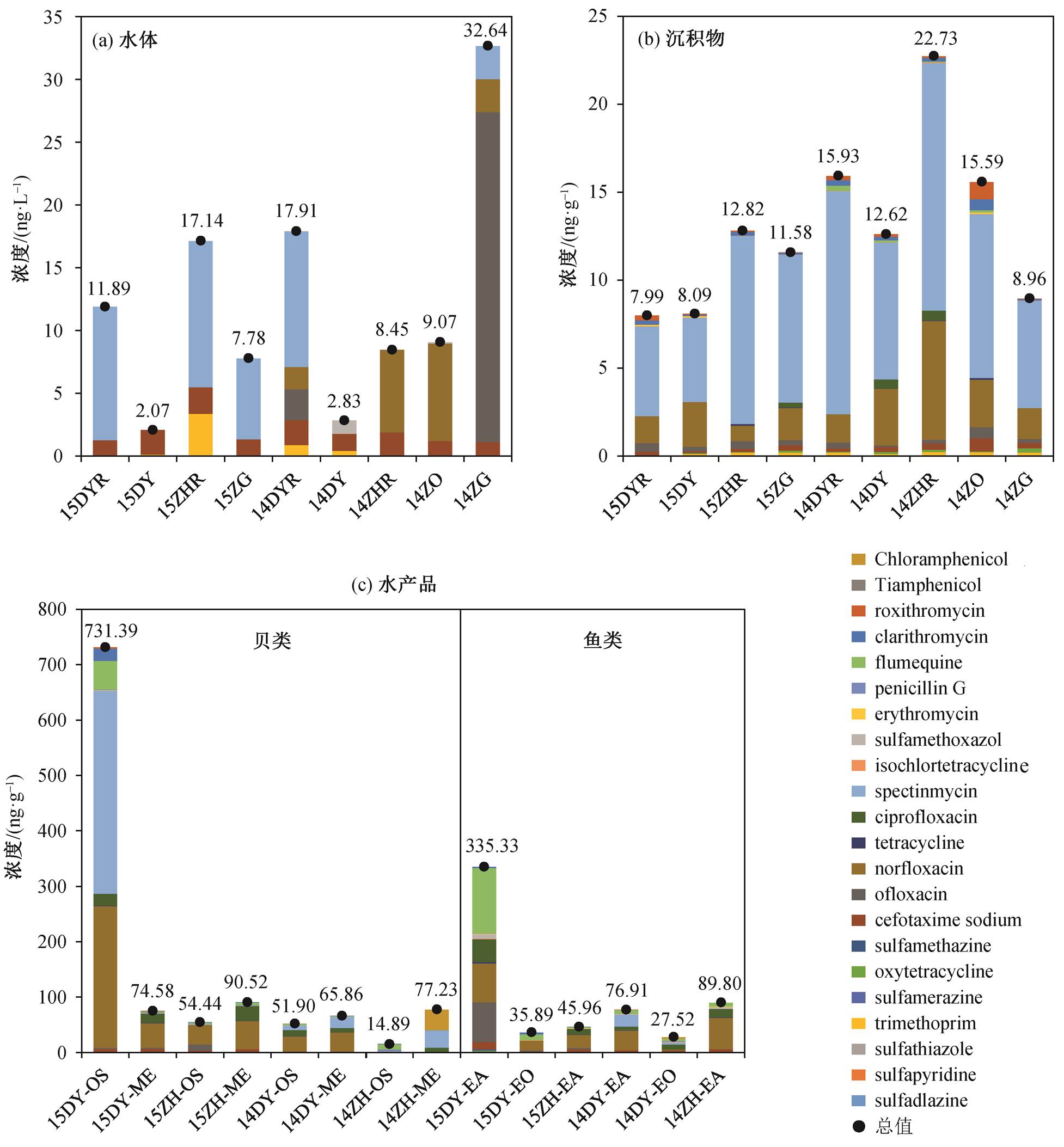
图1 珠江口海水养殖区水体、沉积物和水产品中抗生素的污染情况
Fig. 1 Concentration of antibiotics in water, sediments and aquatic products in aquaculture of the Pearl River estuary
2.3 生物样中抗生素的污染状况
生物样中检出 18 种抗生素, 污染均值为 0.06(磺胺甲基嘧啶)~46.75(诺氟沙星)ng/g(干重)。主要污染物及其均值为诺氟沙星(46.75 ng/g)、奇霉素(32.16ng/g)、氟甲喹(15.70ng/g)、环丙沙星(12.40 ng/g)和氧氟沙星(6.45ng/g), 其他物质均值均小于3.70 ng/g。
从图 1(c)可知, 生物样中∑抗生素的范围为14.89(14ZH-OS)~731.39(15DY-OS)ng/g(干重)。贝类中只有15DY-OS的污染程度(731.39ng/g)远远高于其他样品, 该样品中主要污染物为奇霉素、诺氟沙星和氟甲喹, 贝类其他样品污染程度均匀且较低(∑抗生素<100 ng/g)。鱼类中只有 15DY-EA 的污染程度(335.33 ng/g)远远高于其他样品, 4种喹诺酮类抗生素在该样品中全部检出, 其他样品污染程度均匀且较低(∑抗生素<90 ng/g)。除污染最高的样品外, 贝类、鱼类中抗生素污染程度接近, 样品间无明显差异。贝类中抗生素的污染水平, 大亚湾略高于珠海, 2015 年略高于 2014 年。不同种类水产品中∑抗生素的污染程度为 OS(生蚝, 213.16 ng/g)>EA(青斑, 137.00ng/g)>ME (贻贝, 77.05 ng/g)> EO (白鲳, 31.71 ng/g)。
文献中对生物体内抗生素的研究, 普遍集中在暴露–富集及生物体内药物代谢等方面。有关鱼体内中抗生素累积的研究较少[22–26], 相关研究多集中于美国, 且集中于非抗生素类药物。2009年大亚湾海水养殖鱼类肌肉中检出诺氟沙星、环丙沙星残留, 其中诺氟沙星污染水平突出, 最高残留量为25.00 ng/g (湿重)[6]; 本研究的喹诺酮类抗生素检测结果与之接近, 残留量略高于 2009 年的结果。在水产养殖区附近的野生鱼体内也发现喹诺酮、四环素类和杀寄生虫剂残留[8]。美国河流中多种鱼类肌肉和肝脏中诺氟沙星含量为5.00~130.00ng/g[23]。美国佛罗里达河流的牛鲨血浆中, 诺氟沙星含量为4.08ng/g[25],远低于本实验结果。本实验结果与其他养殖区污染水平相近, 与野生鱼相比, 本实验中水产品的抗生素含量处于中间水平。
2.4 相关性分析
样品之间的相关性分析能在一定程度上表现样品之间污染程度的相似性, 污染程度(主要污染物成分及其贡献率)相似的样品间正相关性显著。表3~6给出珠海和大亚湾水产养殖区水样、沉积物、鱼类和贝类样品的相关性分析结果。
从表 3 可知, 海水样品之间的相关性不好, 大部分表现为较弱的正相关性或较弱的负相关性, 推测原因是不同鱼排上施加抗生素存在时间差, 即不同鱼排上同时施加同种抗生素的可能性很小。只有几个水样样品显著正相关(p<0.01), 其中 15DYR, 15ZHR, 15ZG 和 14DYR 两两之间显著正相关, 其 主要污染物均为奇霉素和头孢噻肟钠, 这两种物质合计在 4 个样品中的污染贡献率为 100%, 80%, 100%和 71%。15DY 与 14DY 之间正相关性显著, 其主要污染物(均为头孢噻肟钠和甲氧苄氨嘧啶)的污染贡献率分别为 100%和 63%。14ZHR 与 14ZO正相关性显著, 主要污染物(诺氟沙星和头孢噻肟钠)的污染贡献率分别为99% 和 99%。
从表 4 可知, 沉积物各样品之间的正相关性显著(p<0.01), 其主要污染物为奇霉素和诺氟沙星, 污染贡献率均在 77%以上, 印证沉积物中抗生素污染差异性小。
从表5可知, 大部分鱼类样品显著正相关。14DY-EO 与其他鱼类相关性不好, 该样品污染程度最低, 主要污染物为环丙沙星、氟甲喹和奇霉素。其他鱼类样品主要污染物为诺氟沙星。
表3 水体样品中抗生素污染的相关性水平
Table 3 Correlation coefficients and significance levels of antibiotics contamination in water samples
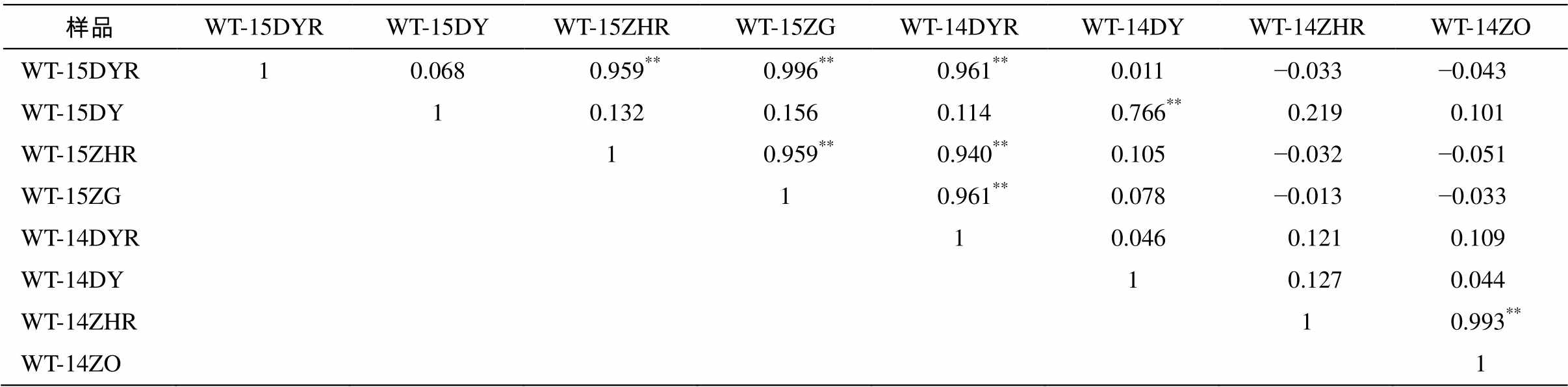
样品WT-15DYRWT-15DYWT-15ZHRWT-15ZGWT-14DYRWT-14DYWT-14ZHRWT-14ZO WT-15DYR10.0680.959**0.996**0.961**0.011−0.033−0.043 WT-15DY10.1320.1560.1140.766**0.2190.101 WT-15ZHR10.959**0.940**0.105−0.032−0.051 WT-15ZG10.961**0.078−0.013−0.033 WT-14DYR10.0460.1210.109 WT-14DY10.1270.044 WT-14ZHR10.993** WT-14ZO1
注: **表示在0.01水平(双侧)上显著相关, *表示在0.05水平(双侧)上显著相关。下同。
表4 沉积物样品中抗生素污染的相关性水平
Table 4 Correlation coefficients and significance levels of antibiotics contamination in sediment samples
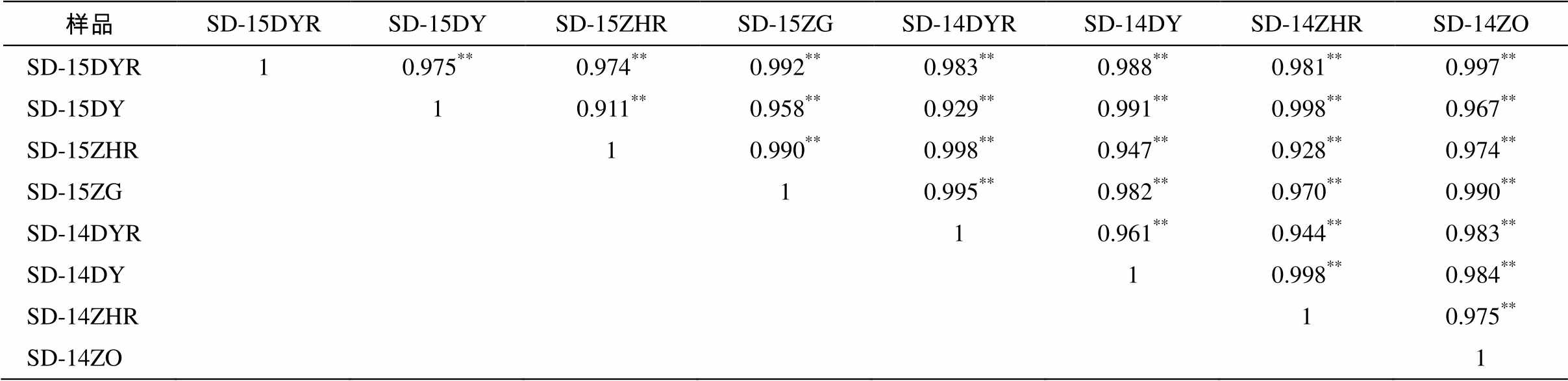
样品SD-15DYRSD-15DYSD-15ZHRSD-15ZGSD-14DYRSD-14DYSD-14ZHRSD-14ZO SD-15DYR10.975**0.974**0.992**0.983**0.988**0.981**0.997** SD-15DY10.911**0.958**0.929**0.991**0.998**0.967** SD-15ZHR10.990**0.998**0.947**0.928**0.974** SD-15ZG10.995**0.982**0.970**0.990** SD-14DYR10.961**0.944**0.983** SD-14DY10.998**0.984** SD-14ZHR10.975** SD-14ZO1
表5 鱼类样品中抗生素污染的相关性水平
Table 5 Correlation coefficients and significance levels of antibiotics contamination in fish samples
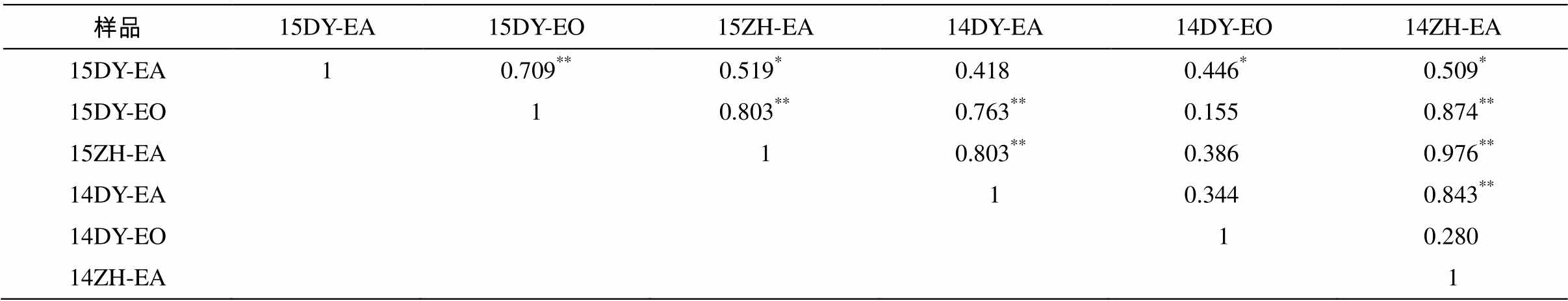
样品15DY-EA15DY-EO15ZH-EA14DY-EA14DY-EO14ZH-EA 15DY-EA10.709**0.519*0.4180.446*0.509* 15DY-EO10.803**0.763**0.1550.874** 15ZH-EA10.803**0.3860.976** 14DY-EA10.3440.843** 14DY-EO10.280 14ZH-EA1
表6 贝类样品中抗生素污染的相关性水平
Table 6 Correlation coefficients and significance levels of antibiotics contamination in shellfish samples
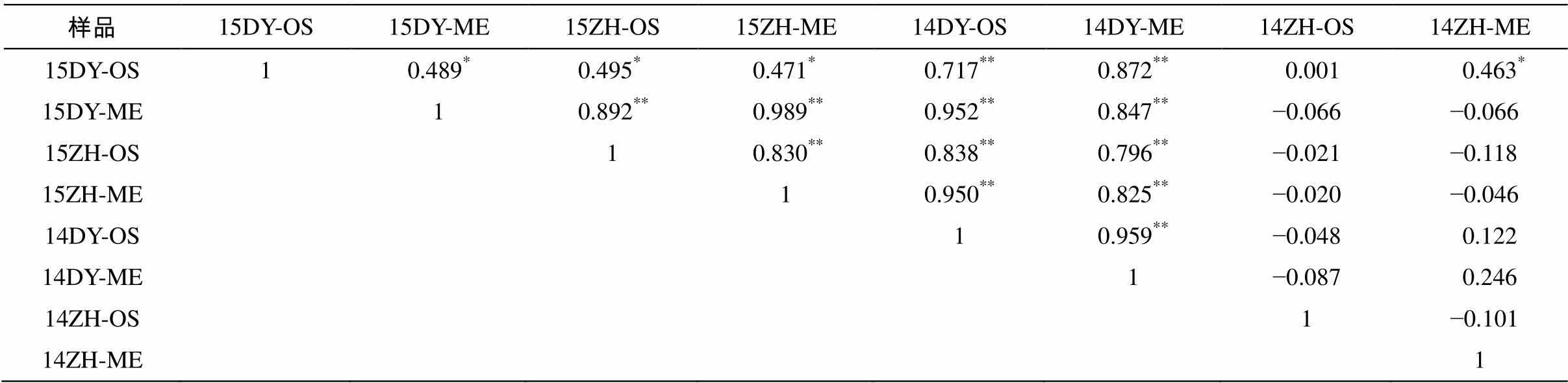
样品15DY-OS15DY-ME15ZH-OS15ZH-ME14DY-OS14DY-ME14ZH-OS14ZH-ME 15DY-OS10.489*0.495*0.471*0.717**0.872** 0.0010.463* 15DY-ME10.892**0.989**0.952**0.847**−0.066−0.066 15ZH-OS10.830**0.838**0.796**−0.021−0.118 15ZH-ME10.950**0.825**−0.020−0.046 14DY-OS10.959**−0.0480.122 14DY-ME1−0.0870.246 14ZH-OS1−0.101 14ZH-ME1
从表 6 可知, 贝类样品中 14ZH-OS 污染程度最低, 主要污染物为氟甲喹和青霉素(污染贡献率合计为 86%); 样品 14ZH-ME 的主要污染物为氯霉素(含量特别突出)和奇霉素(污染贡献率合计为87%); 其他贝类主要污染物为诺氟沙星, 污染贡献率基本上在50%以上。
综上所述, 相关性分析结果表明, 沉积物样品间的污染程度类似, 水产品样品间污染的相似性也较显著, 而不同水样间的污染成分及污染水平差异性较大。
3 结论
本文利用实验室建立的复杂样品前处理及检测分析方法, 调查研究珠海、大亚湾海水养殖区内水样、沉积物、水产品中抗生素的污染现状, 并分析样品间的相关性, 得出以下结论。
1)水样中抗生素的浓度范围为 0.13(磺胺甲恶唑)~4.68(奇霉素)ng/L。养殖区使用喹诺酮类抗生素较普遍。水样中抗生素类物质的污染受水量影响较大; 珠海养殖区污染水平略高于大亚湾。本实验结果低于其他养殖区浓度, 与国内外自然水体相比污染较轻。
2)沉积物中抗生素浓度范围为0.02(金霉素)~8.77 (奇霉素)ng/g(干重)。污染程度2014年秋季略高于 2015 年春季, 珠海略高于大亚湾。与其他养殖区、其他河流的沉积物相比, 珠江口海水养殖区沉积物中抗生素的污染程度较低。
3)水产品中抗生素浓度范围为0.06(磺胺甲基嘧啶)~46.75(诺氟沙星)ng/g(干重)。除污染水平最高的样品外, 贝类、鱼类中抗生素污染程度接近, 样品间无明显差异。贝类中抗生素的污染程度大亚湾略高于珠海, 2015 年略高于 2014 年。不同水产品中抗生素的污染程度为生蚝>青斑>贻贝>白鲳。实验结果与其他养殖区污染水平类似, 与野生鱼相比, 本研究中水产品的抗生素含量处于中间水平。
4)相关性分析结果表明, 沉积物样品间的污染程度类似, 水产品样品间污染的相似性也较显著, 而不同水样间的污染成分及污染水平差异较大。
参考文献
[1]徐维海. 典型抗生素类药物在珠江三角洲水环境中的分布、行为与归宿[D]. 广州: 中国科学院研究生院(广州地球化学研究所), 2007
[2]Burridge L, Weis J S, Cabello F, et al. Chemical use in salmon aquaculture: a review of current practices and possible environmental effects. Aquaculture, 2010, 306(1/2/3/4): 7–23
[3]Kim Y, Choi K, Jung J, et al. Aquatic toxicity of acetaminophen, carbamazepine, cimetidine, diltiazem and six major sulfonamides, and their potential eco-logical risks in Korea. Environment International, 2007, 33(3): 370–375
[4]梁惜梅, 施震, 黄小平. 珠江口典型水产养殖区抗生素的污染特征. 生态环境学报, 2013, 22(2): 304–310
[5]王奇. 珠江三角洲典型养殖区磺胺类抗生素的监测分析及其生物标记物研究[D]. 广州: 暨南大学, 2010
[6]聂湘平, 何秀婷, 杨永涛, 等. 珠江三角洲养殖水体中喹诺酮类药物残留分析. 环境科学, 2009, 30 (1): 266–270
[7]叶计朋, 邹世春, 张干, 等. 典型抗生素类药物在珠江三角洲水体中的污染特征. 生态环境学报, 2007, 16(2): 384–388
[8]乌锡康. 有机化合物环境数据简表. 上海: 华东理工大学出版社, 2009
[9]王敏, 俞慎, 洪有为, 等. 5种典型滨海养殖水体中多种类抗生素的残留特性. 生态环境学报, 2011, 20 (5): 934–939
[10]冀秀玲, 刘芳, 沈群辉, 等. 养殖场废水中磺胺类和四环素抗生素及其抗性基因的定量检测. 生态环境学报, 2011, 20(5): 927–933
[11]Yang J, Ying G, Zhao J, et al. Spatial and seasonal distribution of selected antibiotics in surface waters of the Pearl Rivers, China. Journal of Environmental Science and Health part B-Pesticides Food Contami-nants and Agricultural Wastes, 2011, 46(3): 272–280
[12]Jia A, Hu J, Wu X, et al. Occurrence and source apportionment of sulfonamides and their metabolites in Liaodong Bay and the adjacent Liao River basin, North China. Environmental Toxicology and Chemis-try, 2011, 30(6): 1252–1260
[13]Gao L, Shi Y, Li W, et al. Occurrence, distribution and bioaccumulation of antibiotics in the Haihe River in China. Journal of Environmental Monitoring, 2012, 14(4): 1248–1255
[14]Managaki S, Murata A, Takada H, et al. Distribution of macrolides, sulfonamides, and trimethoprim in tropical waters: ubiquitous occurrence of veterinary antibiotics in the Mekong Delta. Environmental Sci-ence & Technology, 2007, 41(23): 8004–8010
[15]Kolpin D W, Furlong E T, Meyer M T, et al. Phar-maceuticals, hormones, and other organic wastewater contaminants in US streams, 1999-2000: a national reconnaissance. Environmental Science & Technology, 2002, 36(6): 1202–1211
[16]郭美婷, 胡洪营, 王超. 城市污水中的 PPCPs 及其去除特性. 中国给水排水, 2005, 21(10): 31–33
[17]阮悦斐, 陈继淼, 郭昌胜, 等. 天津近郊地区淡水养殖水体的表层水及沉积物中典型抗生素的残留分析. 农业环境科学学报, 2011, 30(12): 2586–2593
[18]Wu R S S. Eutrophication, water borne pathogens and xenobiotic compounds: environmental risks and chal-lenges. 1999, 39(1): 11–22
[19]Castiglioni S, Bagnati R, Fanelli R, et al. Removal of pharmaceuticals in sewage treatment plants in Italy. Environmental Science & Technology, 2006, 40(1): 357–363
[20]Ternes T A, Joss A, Siegrist H. Scrutinizing pharma-ceuticals and personal care products in wastewater treatment. Environmental Science & Technology, 2004, 38(20): 392A–399A
[21]Petrovic M, Hernando M D, Diaz-Cruz M S, et al. Liquid chromatography-tandem mass spectrometry for the analysis of pharmaceutical residues in environ-mental samples: a review. Journal of Chromatography A, 2005, 1067(1/2): 1–14
[22]Brooks B W, Chambliss C K, Stanley J K, et al. Determination of select antidepressants in fish from an effluent-dominated stream. Environmental Toxico-logy and Chemistry, 2005, 24(2): 464–469
[23]Ramirez A J, Brain R A, Usenko S, et al. Occurrence of pharmaceuticals and personal care products in fish: results of a national pilot study in the United States. Environmental Toxicology and Chemistry, 2009, 28 (12): 2587–2597
[24]Subedi B, Du B, Chambliss C K, et al. Occurrence of pharmaceuticals and personal care products in german fish tissue: a national study. Environmental Science & Technology, 2012, 46(16): 9047–9054
[25]Gelsleichter J, Szabo N J. Uptake of human pharma-ceuticals in bull sharks (Carcharhinus leucas) inha-biting a wastewater-impacted river. Science of the Total Environment, 2013, 456: 196–201
[26]Yang J, Li H, Ran Y, et al. Distribution and bio-concentration of endocrine disrupting chemicals in surface water and fish bile of the Pearl River Delta, South China. Chemosphere, 2014, 107: 439–446
Occurrence of Antibiotics in Water, Sediments and Seafood in Aquaculture Area of the Pearl River Estuary
HAO Hongshan, XU Yaru, GAO Yue, WANG Zhifen, LI Jie, XU Nan†
Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; † Corresponding author, E-mail: xunan@pkusz.edu.cn
AbstractThe occurrence of 22 antibiotics in water samples, sediments, fish and shellfish in aquaculture area of the Pearl River Estuary (Zhuhai and Daya Bay) was studied, using ultrasonic extraction combined with ultra-performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS). The main pollutants detected in aquaculture area of the Pearl River Estuary are quinolones such as norfloxacin, ofloxacin, ciprofloxacin and flumequine. Higher ∑antibiotics were observed in Zhuhai Bay in water and sediments compared with Daya Bay. The concentrations of antibiotics in water samples, ranging from 0.13 (sulfamethoxazole) to 4.68 (spectinomycin) ng/L on average, were strongly affected by precipitation. The concentrations of antibiotics in sediments, ranging from 0.02 (isochlortetracycline) to 8.77 (spectinomycin) ng/g (dry weight) on average, accumulated over time. The concentrations of antibiotics in seafood ranged from 0.06 (sulfamerazine) to 46.75 (norfloxacin) ng/g (dry weight). The concentration levels of antibiotics in shellfish and fish were similar and did not show any significant difference. The correlation analysis showed that the concentration levels of antibiotics among sediments were the same; for most seafood, it was same; and for water samples, the difference was great.
Key wordsantibiotics; Pearl River estuary; aquaculture area; water; sediments; seafood
中图分类号X703
doi:10.13209/j.0479-8023.2018.018
深圳市科技研发资金基础研究项目(JCYJ20150629144818001)资助
收稿日期:2017-05-23;
修回日期:2017-05-29;
网络出版日期:2018-06-11






