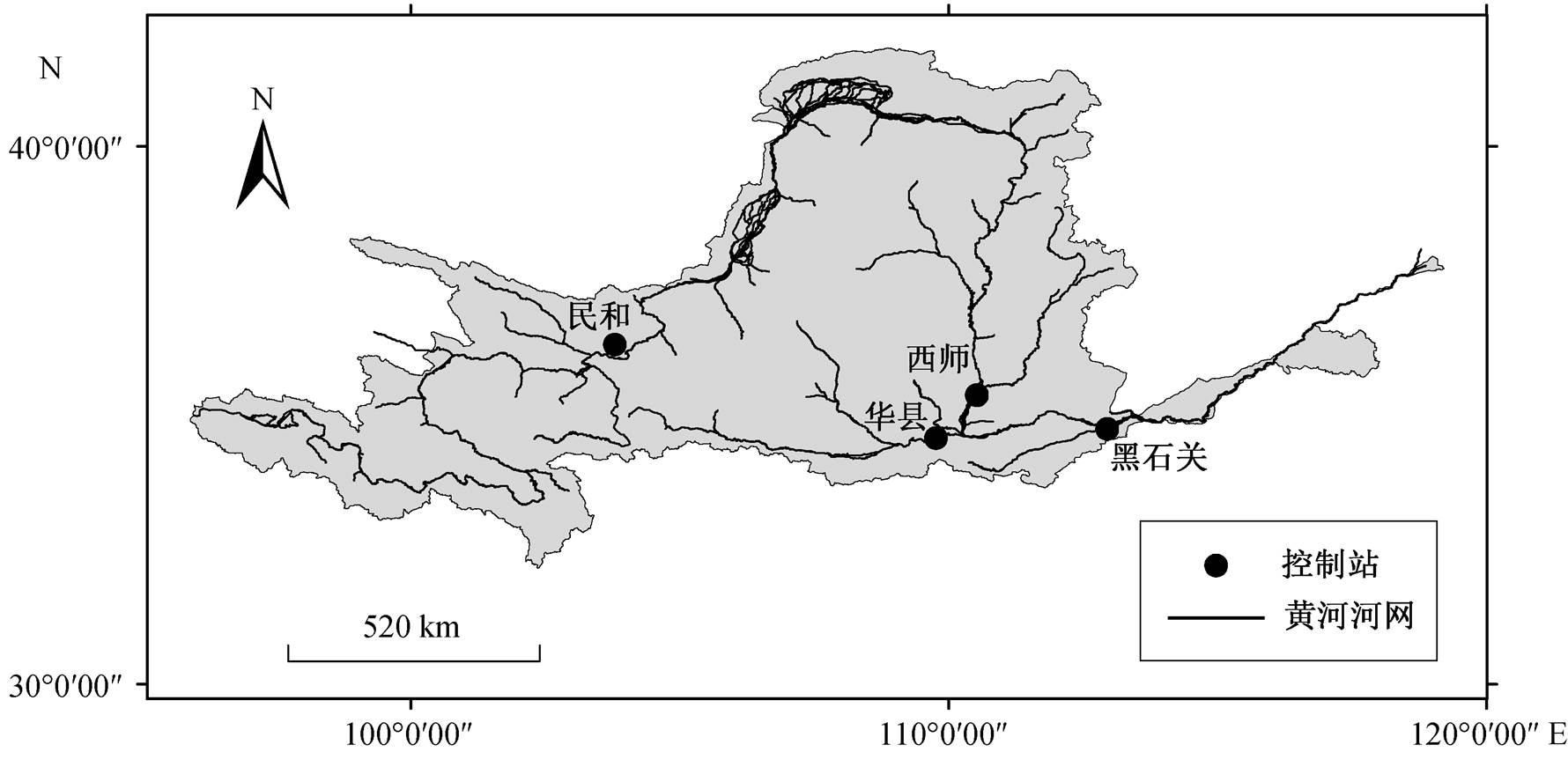
图1 研究区域及采样断面
Fig. 1 Research area and sampling sites
谢元1,2蒋晓辉3王婷2许旭明2倪晋仁1,2,†
1.北京大学深圳研究生院环境与能源学院, 深圳 518055; 2.北京大学环境工程系, 教育部水沙科学重点实验室, 北京 100871; 3.黄河水利科学研究院, 郑州 450003; †通信作者, E-mail: nijinren@iee.pku.edu.cn
摘要基于2015年春季(4月)和秋季(10月)在黄河流域湟水、汾河、渭河和洛河等入干支流采集的底栖动物样品, 开展支流入干区底栖动物群落结构特征比较研究。监测结果表明, 春秋两季在各支流入干区采集到的底栖动物种属数量排序为洛河(28种)>湟水(26种)>汾河(23种)>渭河(17种); 支流入干区春秋两季优势功能摄食类群皆为牧食收集者(除洛河在秋季以刮食者为主外)。底栖动物群落的除趋势对应分析表明, 底质对底栖动物群落分布起重要作用, 水草等水生植物的存在利于底栖动物生存。进一步地, 底栖动物群落与环境因子的冗余分析表明, pH和电导率是影响底栖动物群落的关键因子。从物种组成、密度、生物量、功能摄食类群和群落与生境因子关系等方面研究了底栖动物的群落结构, 较为系统地揭示了黄河主要支流入干区的底栖动物分布特征, 研究结果可为黄河水生生物群落结构的系统性研究提供支撑。
关键词黄河; 支流入干区; 底栖动物; 群落结构; 底质; 环境因子
河流系统不仅具有泄洪、输沙、供水、自净、航运、发电和景观等多种功能[1], 而且能够在一定程度上调节气候、改善生态环境和维护生物多样性[2–3]。近年来, 人类活动加剧与污染排放量增大使得河流生态系统受到严重威胁[4], 维护河流生态系统的健康成为众多学者的共识和河流管理的重要目标[4–6]。
大型底栖无脊椎动物(简称底栖动物)指不能通过500µm孔径网筛的无脊椎动物, 是河流生态系统中最重要的定居动物代表类群之一, 通过摄食、掘穴和建管等活动直接或间接地影响河流生态系统的物质分解、能量流动和营养循环[5]。底栖动物种类丰富, 大多数有相对较长的生活史和较固定的生活场所, 对化学污染和物理变化有较广泛的耐受性, 能够综合反映河流质量的长期变化[7–9]。底栖动物作为水生态系统中重要的指示性物种已在河流研究中受到高度重视。
目前, 关于黄河支流入干区底栖动物群落的研究较少。蒋晓辉等[10]和傅小城等[11]报道了黄河部分支流入干区底栖动物的概况, 殷旭旺等[12]研究了渭河流域底栖动物群落与环境因子的关系, 但目前仍缺乏对主要支流入干区底栖动物群落的系统研究。鉴于上述情况, 我们于 2015 年春季(4 月)和秋季(10 月)对湟水、汾河、渭河和洛河入干区开展了系统的调查, 目的是阐释黄河支流入干区底栖动物群落的特征, 分析不同支流入干区底栖动物群落的分布规律和影响底栖动物丰度及分布的主要因子, 为黄河水生生物群落结构的系统性研究提供支撑。
黄河沿途汇入支流众多, 流域面积大于10000 km2的支流中, 渭河是黄河最大的支流, 汾河是黄河的第二大支流, 湟水是黄河上游最大的支流, 洛河是黄河下游主要水量来源之一。这4条支流是黄河流域的典型支流, 受人类活动影响较大。根据湟水、汾河、渭河和洛河的国家水文站点分布, 对应设置4个调查断面, 如图1所示。根据生境特征, 在每个断面0~1.5m水深范围内左右两岸各布设4个采样点, 每种生境采样面积为1m2, 在采集底栖动物样品的同时也采集水体样品。采样时间为2015年春季(4月)和秋季(10月)。
底栖动物采样方法视生境情况而异, 在卵石底质为主的河道内用孔径500μm的踢网采集样本, 在沙–淤泥底质为主的河道内则用彼得逊采泥器(1/16m2)采集样本。底栖动物样品采集当天, 经孔径500μm 的筛网筛洗后, 置于白色解剖盘中分捡, 将分拣出的底栖动物用10%的甲醛溶液固定。运回实验室后, 进行鉴定、计数和称重。水生昆虫一般鉴定到科或属级水平, 寡毛纲和软体动物门一般鉴定到种级水平。称重时先用滤纸吸干水分, 然后在电子天平上称量。

图1 研究区域及采样断面
Fig. 1 Research area and sampling sites
采集的水体样品低温(0~4ºC)保存, 运回实验室后检测水体的pH值、氨氮(NH3-N)、五日生化需氧量(BOD5)、化学需氧量(COD)、溶解氧(DO)和悬浮物(SS)等指标, 检测方法参考《HJ/T91—2002 地表水和污水检测技术规范》。现场测定水深(h)、透明度(T)、流速(v)和电导率(Cond), 水深和透明度分别用测深锤和萨氏盘测量, 流速用L型毕托管流速仪测定, 电导率用YSI 6600 V2多参数水质监测仪测量。水温(WT)、高程(H)和流量(Q)数据从水文局获得。
根据摄食对象及特点, 将底栖动物功能摄食类群分为牧食收集者(GC)、滤食收集者(FC)、刮食收集者(SC)、捕食收集者(PR)和撕食收集者(SH)。如果某种底栖动物有几种可能的归属, 统计时将密度和生物量均分到相应类群[13–15]。根据底质颗粒的粒径, 将底质分为淤泥、细沙、粗砂和鹅卵石[16]。
除趋势对应分析(detrended correspondence ana-lysis, DCA)是将样方或物种对排序轴求得的分数重新划分, 并排列在一定空间的方法, 能够分析可视化样方或物种的分布关系。约束性排序是分析底栖动物群落与环境因子关系的方法, 根据物种数据除趋势对应分析得到的排序轴长度最大值来确定是使用典范对应分析(CCA)还是冗余分析(RDA)(梯度长度>4, 采用单峰模型; 梯度长度<3, 采用线性模型; 3<梯度长度<4; 单峰或线性模型均可)[17]。利用Monte Carlo检验(999置换,p<0.05)筛选出具有重要且独立作用的最少环境因子组合。为了优化分析, 对物种数据和环境数据进行ln(x+1)转化。
表1给出黄河支流入干区底栖动物的种类名录, 湟水、汾河、渭河和洛河入干区春秋两季共采集到53种, 隶属于25科47属。
湟水春秋两季共采集到26种, 隶属于9科22属。其中, 春季采集到9种, 隶属于6科9属, 密度和生物量分别为28.2ind/m2和0.82g/m2, 优势种为哑口仙女虫(Nais elinguis)、真开氏摇蚊(Eukiefferiellasp.)和水摇蚊(Hydrobaenussp.); 秋季采集到24种, 隶属于8科19属, 密度和生物量分别为113.5ind/m2和 0.15g/m2, 优势种为哑口仙女虫 (Nais elinguis)、多足摇蚊(Polypedilumsp.)和纹石蛾科(Hydropsy-
chidae)。
汾河春秋两季共采集到23种, 隶属于10科22属。其中, 春季采集到19种, 隶属于7科18属, 密度和生物量分别为191.1ind/m2和0.04g/m2, 优势种为霍甫水丝蚓(Limnodrilus hoffmeisteri)和苏式尾鳃蚓(Branchiura sowerbyi); 秋季采集到10种, 隶属于6科6属, 密度和生物量分别为1005.4 ind/m2和0.89 g/m2, 优势种为摇蚊属(Chironomussp.)。
渭河春秋两季共采集到17种, 隶属于5科15属。其中, 春季采集到12种, 隶属于5科11属, 密度和生物量分别为48.9 ind/m2和0.04g/m2, 优势种为正颤蚓(Tubifex tubifex)、多足摇蚊(Polypedilumsp.)和拟枝角摇蚊(Paracladopelmasp.); 秋季采集到9种, 隶属于2科8属, 密度和生物量分别为26ind/m2和0.01 g/m2, 优势种为摇蚊属(Chironomussp.)。
洛河春秋两季共采集到28种, 隶属于19科28属。其中, 春季采集到20种, 隶属于13科20属, 密度和生物量分别为33.6ind/m2和1.96g/m2, 优势种为多足摇蚊(Polypedilumsp.)和椭圆萝卜螺(Radix swinhoei); 秋季采集到10种, 隶属于10科10属, 密度和生物量分别为3.9ind/m2和2.56g/m2, 优势种为翼蛉科(Osmylidae)和鳞翅目一种(Elophilasp.)。
湟水、汾河、渭河和洛河入干区春秋两季三大门密度比例热图如图2(a)所示。湟水春季优势门类为环节动物门, 其个体数占总个体数的79.9%; 秋季优势门类为节肢动物门, 其个体数占总个体数的64%。汾河春季优势门类为环节动物门, 其个体数占总个体数的78.1%; 秋季优势门类为节肢动物门, 其个体数占总个体数的99%。渭河春季优势门类为节肢动物门, 其个体数占总个体数的90.2%; 秋季优势门类为节肢动物门, 其个体数占总个体数的73%。洛河春季优势门类为节肢动物门, 其个体数占总个体数的63.2%; 秋季优势门类为节肢动物门, 其个体数占总个体数的51.6%。
湟水、汾河、渭河和洛河入干区春秋两季功能摄食类群密度比例热图如图2(b)所示。湟水春季优势功能摄食类群为牧食收集者, 其个体数占总个体数的89%; 秋季优势功能摄食类为牧食收集者, 其个体数占总个体数的88.9%。汾河春季优势功能摄食类群为牧食收集者, 其个体数占总个体数的97.4%; 秋季优势功能摄食类群为牧食收集者和刮食者, 其个体数占总个体数的32.3%和27.6%。渭河春季优势功能摄食类群为牧食收集者, 其个体数占总个体数的56.8%; 秋季优势功能摄食类群为牧食收集者, 其个体数占总个体数的50%。洛河春季优势功能摄食类群为牧食收集者, 其个体数占总个体数的75%; 秋季优势功能摄食类群为刮食者, 其个体数占总个体数的34.6%。
表1 黄河支流入干区底栖动物种类名录
Table 1 Taxa list of benthic macroinvertebrate in the confluence areas from tributaries to mainstream of Yellow River


底质是保障底栖动物生存的首要生境条件。水深, 流速和水草、苔藓及着生藻类等水生植物是影响底栖动物群落密度、生物量和多样性的重要生境因素。各支流入干区的生境要素如表2所示。为了解底栖动物群落的分布关系, 对物种密度数据进行除趋势对应分析, 排序见图3。湟水春秋两季底栖动物群落聚在一起, 汾河秋季、渭河秋季和洛河春季底栖动物群落聚在一起, 汾河春季和渭河春季底栖动物群落聚在一起, 洛河秋季底栖动物群落单独在一个点。相同底质类型的底栖动物群落聚在一起, 不同底质类型的分化较明显, 表明底质对底栖动物群落分布有至关重要的作用。
底质对底栖动物的影响主要体现在密实性、稳定性和异质性三个方面。湟水春秋两季底质类型均为鹅卵石, 其中秋季生境有水草存在, 湟水秋季采集到24种底栖动物, 物种丰度为入干区最高值。鹅卵石表面润滑, 水流从石间空隙中畅流, 受水流冲刷输移的可能性一般较低, 稳定性高, 可以为动物提供较稳定的微生境[18–19], 故底栖动物组成丰富; 同时, 水草的存在为底栖动物提供食物与栖息、繁殖和避难场所, 还能稳定底质, 降低大流量水流对底栖动物的冲击[20–21], 故湟水秋季底栖动物物种丰度最高。汾河秋季、渭河秋季和洛河春季的底质类型均为淤泥, 其中洛河春季生境有大量水草存在, 汾河秋季、渭河秋季和洛河春季优势功能摄食类群均为牧食收集者, 汾河秋季和渭河秋季优势种均为摇蚊属(Chironomussp.)。洛河春季采集到 20 种底栖动物, 物种的组成较丰富, 优势种为多足摇蚊(Polypedilumsp.)。淤泥为富有机质的软泥, 利于摇蚊科幼虫和颤蚓科等牧食收集者生存[22–23], 水草的存在使洛河春季的物种丰度多于洛河秋季和渭河秋季。汾河春季和渭河春季底质类型均为细沙, 生物量相同且仅为0.04g/m2, 细沙空隙小, 为底栖动物创造的活动空间小, 对底栖动物不利, 故物种丰度和生物量较低。洛河秋季的底质类型为粗砂, 底栖动物密度仅为3.9ind/m2, 水流流速仅为0.01m/s, 存在长臂虾科(Palaemonidae)、钩虾科(Gammaridae)和淡水壳菜(Limnoperna lacustris)等物种。粗砂底质密实性高且稳定性差, 易发生冲淤和翻移, 不能为底栖动物提供一个适宜的生存空间[24–25], 故底栖动物密度较低。当水流流速较低时, 虾类、双壳刚、腹足纲和摇蚊幼虫可以生存[26]。
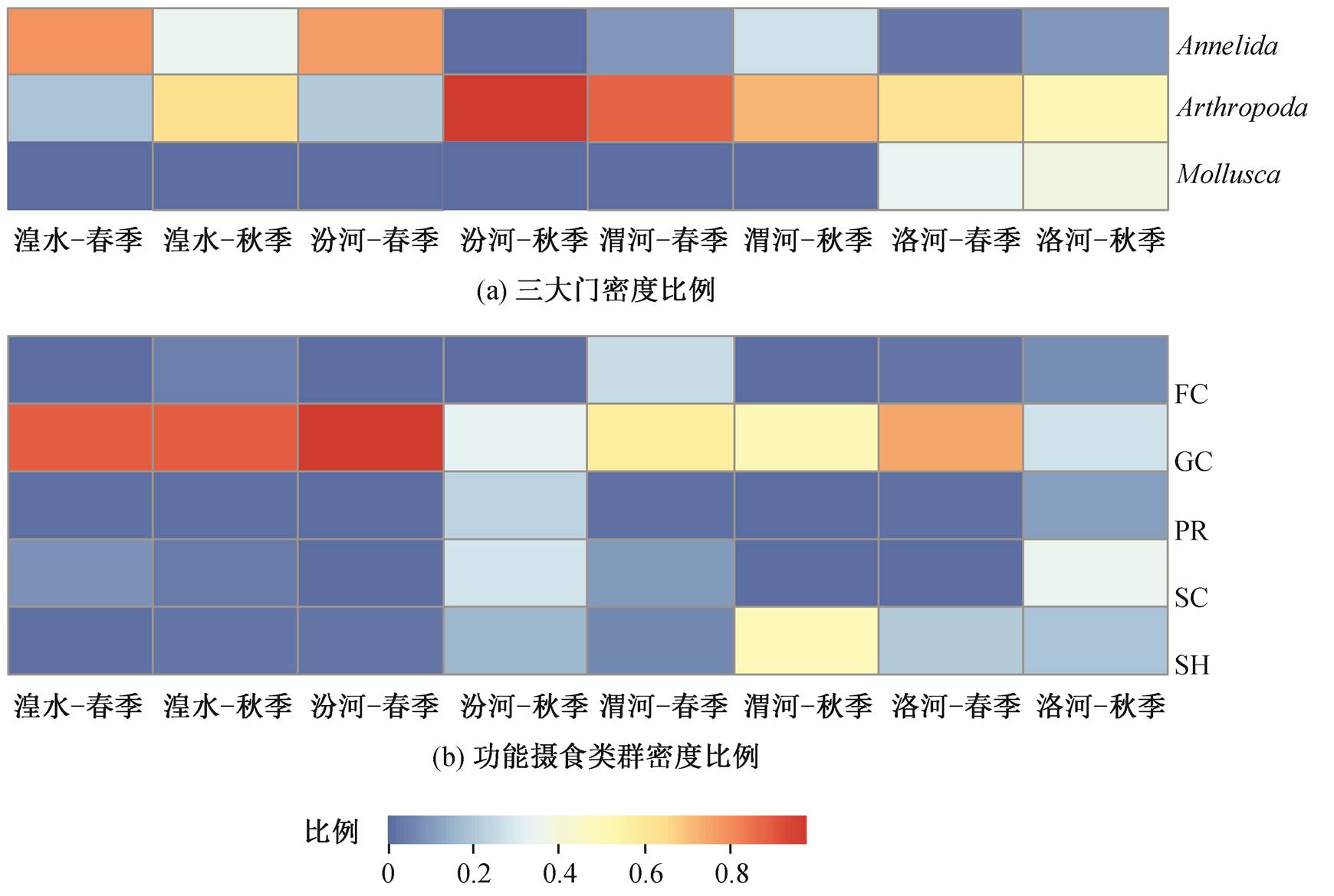
图2 春秋两季的三大门密度比例和功能摄食类群密度比例热图
Fig. 2 Groups of the benthic macroinvertebrate community and functional feeding groups of the benthic macroinvertebrate community in both seasons
表2 支流入干区生境要素
Table 2 Habitat elements of confluence

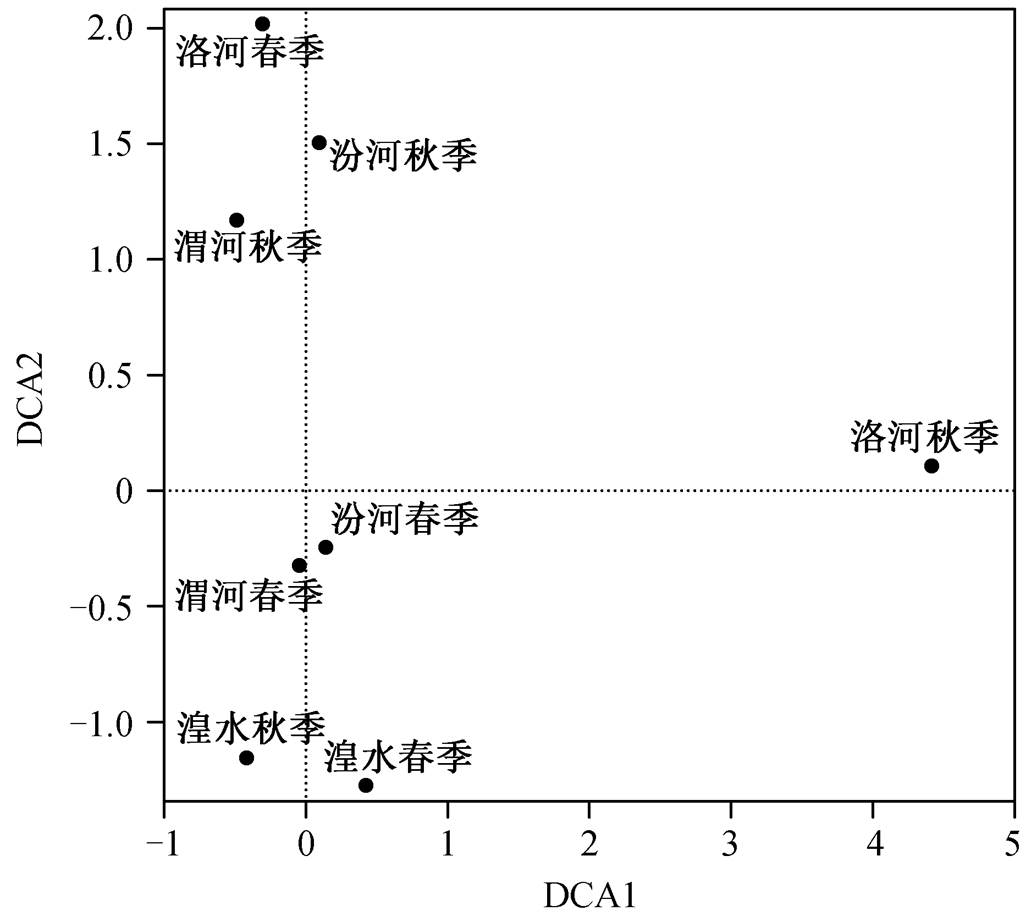
图3 入干区底栖动物群落除趋势对应分析排序
Fig. 3 Ordination diagram of benthic macroinvertebrate in confluence by detrended correspondence analysis (DCA)
为研究环境因子是否存在相关性, 对因子两两计算Spearman相关系数, 图4为环境因子Spearman相关矩阵。以R2绝对值大于0.8作为强相关标准, 以p值小于0.05作为显著性标准。氨氮与化学需氧量显著强相关, 电导率与五日生化需氧量显著强相关。其他大部分指标之间相关系数的绝对值小于0.8, 且p值大于0.05, 说明这些因子没有显著性强相关关系, 自由度较高。因此, 除化学需氧量和五日生化需氧量以外, 其他皆可作为自由的环境影响因子。

***p<0.001, **p<0.01, *p<0.05, ·p<0.1
图4 环境因子Spearman相关矩阵
Fig. 4 Spearman correlation matrix of environmental factors
为了了解影响底栖动物群落的环境因子, 对底栖动物物种密度数据和环境因子数据进行约束性排序。为优化分析, 降低稀有物种的权重, 选择至少出现2次的物种进行约束性排序。除趋势对应分析轴长最大值小于 3, 属于单峰模型, 故使用冗余分析(RDA)。通过前选和 Monte Carlo 转置法分析(p<0.05)筛选影响底栖动物的主要环境因子, 保留了两个环境变量, 按解释力大小排序依次为 pH 和电导率。环境因子的显著性检验结果见表 3, pH 和电导率与底栖动物群落显著强相关。对筛选得到的环境因子和底栖动物群落进行冗余分析(排序见图5), 结果很好地反映了底栖动物与环境因子的关系。其中, 苏式尾鳃蚓(Branchiura sowerbyi)和霍甫水丝蚓(Limnodrilus hoffmeisteri)等寡毛类与电导率正相关, 软体动物椭圆萝卜螺(Radix swinhoei)与电导率负相关, pH和电导率共同解释了底栖动物物种数据47.52%的变化。
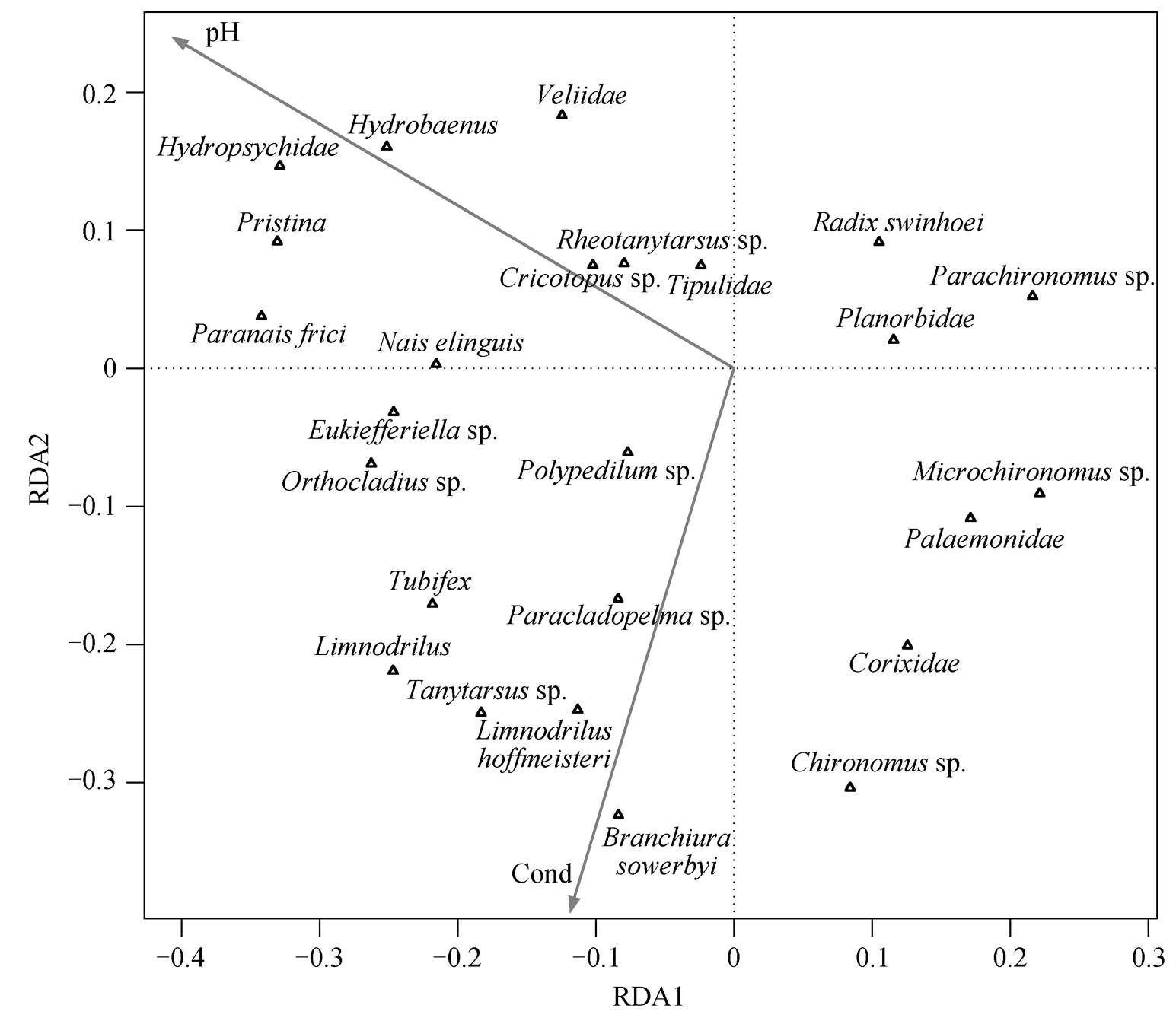
图5 底栖动物群落冗余分析
Fig. 5 RDA of benthic macroinvertebrate community
表3 环境因子相关显著性检验
Table 3 Test for significant correlation with environmental factors

pH反映水体的酸碱度。研究表明, pH是影响底栖动物的出生率、成活率和导致多样性变化的重要因子[27]。汪星等[28]发现pH是影响洞庭湖典型断面底栖动物种类分布格局的主要因子, 蒋万祥等[29]发现pH对底栖动物功能摄食类群组成、密度、生物多样性及群落结构均有显著影响, 迟国梁等[30]发现pH是影响横石水河底栖动物群落的关键因子。本研究结果也表明pH是影响底栖动物群落的关键因子。
水体电导率的数值由溶解于其中的各种阴阳离子的浓度决定, 溶解于水体中的离子能够为底栖动物的生存提供必需的矿物质离子[31]。离子主要通过离子代谢、渗透平衡、细胞内膜间隔作用和能量代谢系统对底栖动物产生影响[32–33]。较多的研究也证明, 电导率能够显著地影响底栖动物物种存活和群落结构的稳定性, 电导率是影响底栖动物, 特别是寡毛类和软体动物的重要环境因子[34]。李艳利等[35]发现电导率是造成浑太河流域底栖动物群落退化的重要环境因子, 殷旭旺等[36]发现电导率是影响渭河底栖动物群落的主要环境因子。本研究的结果也表明, 电导率是影响底栖动物群落的关键 因子。
本研究基于2015年春季(4月)和秋季(10月)在黄河流域湟水、汾河、渭河和洛河的入干支流采集的底栖动物样品, 从物种组成、密度、生物量、功能摄食类群和群落与生境因子关系等方面研究底栖动物的群落结构, 得到以下结论。
1)春秋两季各支流入干区采集的底栖动物种属数量排序为洛河(28种)>湟水(26种)>汾河(23种)>渭河(17种); 支流入干区春秋两季优势功能摄食类群皆为牧食收集者(除洛河在秋季以刮食者为主外)。
2)底质对底栖动物群落的分布起重要作用, 水草等水生植物的存在有利于增强底质的稳定性并 为底栖动物提供食物与栖息场所, 有利于底栖动物 生存。
3)pH和电导率是影响春秋两季各支流入干区底栖动物群落的主要环境因子, 其中电导率是影响寡毛类和软体动物分布的主要环境因子。
致谢 样品采集得到陈秀粉同学和李宝麟先生的帮助, 样品鉴定得到周雄东同学的帮助, 在此表示衷心感谢。
参考文献
[1]倪晋仁, 刘元元. 河流健康诊断与生态修复. 中国水利, 2006(13): 4–10
[2]Karr J R, Chu E W. Sustaining living rivers. Hydro- biologia, 2000, 422/423: 1–14
[3]蔡庆华, 唐涛, 邓红兵. 淡水生态系统服务及其评价指标体系的探讨. 应用生态学报, 2003, 14(1): 135–138
[4]唐涛, 蔡庆华, 刘建康. 河流生态系统健康及其评价. 应用生态学报, 2002, 13(9): 1191–1194
[5]戴纪翠, 倪晋仁. 底栖动物在水生生态系统健康评价中的作用分析. 生态环境学报, 2008, 17(5): 2107–2111
[6]吴阿娜, 杨凯, 车越, 等. 河流健康状况的表征及其评价. 水科学进展, 2005, 16(4): 602–608
[7]Couceiro S R M, Hamada N, Forsberg B R, et al. A macroinvertebrate multimetric index to evaluate the biological condition of streams in the Central Amazon region of Brazil. Ecological Indicators, 2012, 18: 118–125
[8]Helson J E, Williams D D. Development of a macro-invertebrate multimetric index for the assessment of low-land streams in the neotropics. Ecological Indica-tors, 2013, 29(3): 167–178
[9]Huang Q, Gao J, Cai Y, et al. Development and appl-ication of benthic macroinvertebrate-based multimetric indices for the assessment of streams and rivers in the Taihu Basin, China. Ecological Indicators, 2015, 48 (1): 649–659
[10]蒋晓辉, 王洪铸. 黄河干流水生态系统结构特征沿程变化及其健康评价. 水利学报, 2012, 39(8): 991–998
[11]傅小城, 叶麟, 徐耀阳, 等. 黄河主要水系水环境与底栖动物调查研究. 生态科学, 2010, 29(1): 1–7
[12]殷旭旺, 李庆南, 朱美桦, 等. 渭河丰、枯水期底栖动物群落特征及综合健康评价. 生态学报, 2015, 35(14): 4784–4796
[13]Barbour M T, Gerritsen J, Snyder B D, et al. Rapid bioassessment protocols for use in wadeable streams and rivers: periphyton, benthic macroinvertebrates and fish. 2nd ed. Washington, DC: US Environmental Protection Agency, 1999
[14]梁彦龄, 王洪铸. 底栖动物//刘建康. 高级水生生物学. 北京: 科学出版社, 1999: 241–259
[15]Merritt R W, Cummins K W.An introduction to the aquatic insects of North American. 4th ed. Dubuque: Kendall Hunt Publishing Company Press, 2008
[16]Allan J D, Castillo M M. Stream Ecology. Dordrecht: Springer, 2007
[17]Šmilauer P, Lepš J. Multivariate analysis of ecolo-gical data using CANOCO. Cambridge: Cambridge University Press, 2003
[18]Bunn S E, Davies P M. Why is the stream fauna of south-western Australia so impoverished?. Hydrobio-logia, 1990, 194(2): 169–176
[19]Hax C L, Golladay S W. Flow disturbance of macro-invertebrates inhabiting sediments and woody debris in a prairie stream. American Midland Naturalist, 1998, 139(2): 210–223
[20]Grubaugh J, Wallace B, Houston E. Production of benthic macroinvertebrate communities along a sou-thern Appalachian river continuum. Freshwater Bio-logy, 1997, 37(3): 581–596
[21]Reice S R. The role of substratum in benthic macroin-vertebrate microdistribution and litter decomposition in a woodland stream. Ecology, 1980, 61(3): 580–590
[22]Strayer D, Lowell D. The benthic micrometazoans of Mirror Lake, New Hampshire. Archiv für Hydrobio-logie, 1985, 72(Supp l): 287–426
[23]Wang S. The effects of eutrophication on the diversity of zoobenthos in Donghu Lake. Acta Hydrobiologica Sinica, 1996, 20(Suppl 1): 75–89
[24]Verdonschot P K M. Hydrology and substrates: determinants of oligochaete distribution in lowland streams (The Netherlands). Hydrobiologia, 2001, 463 (1/2/3): 249–262
[25]Jowett I G. Hydraulic constraints on habitat suita-bility for benthic invertebrates in gravel-bed rivers. River Research & Applications, 2003, 19(5/6): 495–507
[26]段学花. 底栖动物与河流生态评价. 北京: 清华大学出版社, 2010
[27]Thomsen A G, Friberg N. Growth and emergence of the stoneflyLeuctra nigrain coniferous streams with contrasting pH. Freshwater Biology, 2002, 47(6): 1159–1172
[28]汪星, 郑丙辉, 刘录三, 等. 洞庭湖典型断面底栖动物组成及其与环境因子的相关分析. 中国环境科学, 2012, 32(12): 2237–2244
[29]蒋万祥, 贾兴焕, 唐涛, 等. 底栖动物功能摄食类群对酸性矿山废水的响应. 生态学报, 2016, 36(18): 5670–5681
[30]迟国梁, 赵颖, 官昭瑛, 等. 广东横石水河大型底栖动物群落与环境因子的关系. 生态学报, 2010, 30(11): 2836–2845
[31]张远, 丁森, 赵茜, 等. 基于野外数据建立大型底栖动物电导率水质基准的可行性探讨. 生态毒理学报, 2015, 10(1): 204–214
[32]Pritchard J B, Renfro J L. Renal sulfate transport at the basolateral membrane is mediated by anion ex-change. Proceedings of the National Academy of Sciences, 1983, 80(9): 2603–2607
[33]Kuo S M, Aronson P S. Oxalate transport via the sulfate/HCO3exchanger in rabbit renal basolateral membrane vesicles. Journal of Biological Chemistry, 1988, 263(20): 9710–9717
[34]Miserendino M L. Macroinvertebrate assemblages in Andean Patagonian rivers and streams: environmental relationships. Hydrobiologia, 2001, 444(1): 147–158
[35]李艳利, 李艳粉, 徐宗学. 影响浑太河流域大型底栖动物群落结构的环境因子分析. 环境科学, 2015, 36(1): 94–106
[36]殷旭旺, 渠晓东, 李庆南, 等. 基于着生藻类的太子河流域水生态系统健康评价. 生态学报, 2012, 32(6): 1677–1691
Comparative Study on Macroinvertebrate Communities in Confluence Areas from Typical Tributaries to Mainstream of the Yellow River
XIE Yuan1,2, JIANG Xiaohui3, WANG Ting2, XU Xuming2, NI Jinren1,2,†
1. School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Key Laboratory of Water and Sediment Sciences (MOE), Department of Environmental Engineering, Peking University, Beijing 100871; 3. Yellow River Institute of Hydraulic Research, Zhengzhou 450003; † Corresponding author, E-mail: nijinren@iee.pku.edu.cn
AbstractThe benthic macroinvertebrate communities in the confluence areas from tributaries to mainstream could play an important role in understanding interactions between materials flows from rivers and their ecological consequences. Based on monitoring on conducted in the four typical tributaries (Huangshui River, Fenhe River, Weihe River and Luohe River) to the Yellow River during spring and autumn in 2015, the characteristics of macroinvertebrate communities are systematically compared. As results, sorted by the number of macroinvertebrate species in both seasons for all confluences, Luohe River (28)>Huangshui River (26)>Fenhe River (23)>Weihe River (17). Moreover, the collecter-gather becomes dominant functional feeding group in both seasons for all confluences except scraper dominated in autumn in Luohe River. Detrended Correspondence Analysis (DCA) reveals that substrate is of significance in structuring benthic macroinvertebrate communities. The survival of aquatic plants seems more favorable to survival of benthic macroinvertebrate. Furthermore, Redundancy Analysis (RDA) suggests that benthic macroinvertebrate communities are mainly influenced by pH and conductivity. The present study provides new information on species composition, density, biomass, functional feeding group of benthic macroinvertebrate communities, and the relationship between macroinvertebrate communities and habitat factors, which would be of particular use to deeper understand the aquatic organism in the Yellow River receiving tributaries, which are interfered to various degree by human activities.
Key wordsYellow River; confluence; benthic macroinvertebrate; community structure; substrate; environmental factors
中图分类号X835
doi:10.13209/j.0479-8023.2018.014
国家自然科学基金(91647211)资助
收稿日期:2017-05-21;
修回日期:2017-06-02;
网络出版日期:2018-04-03