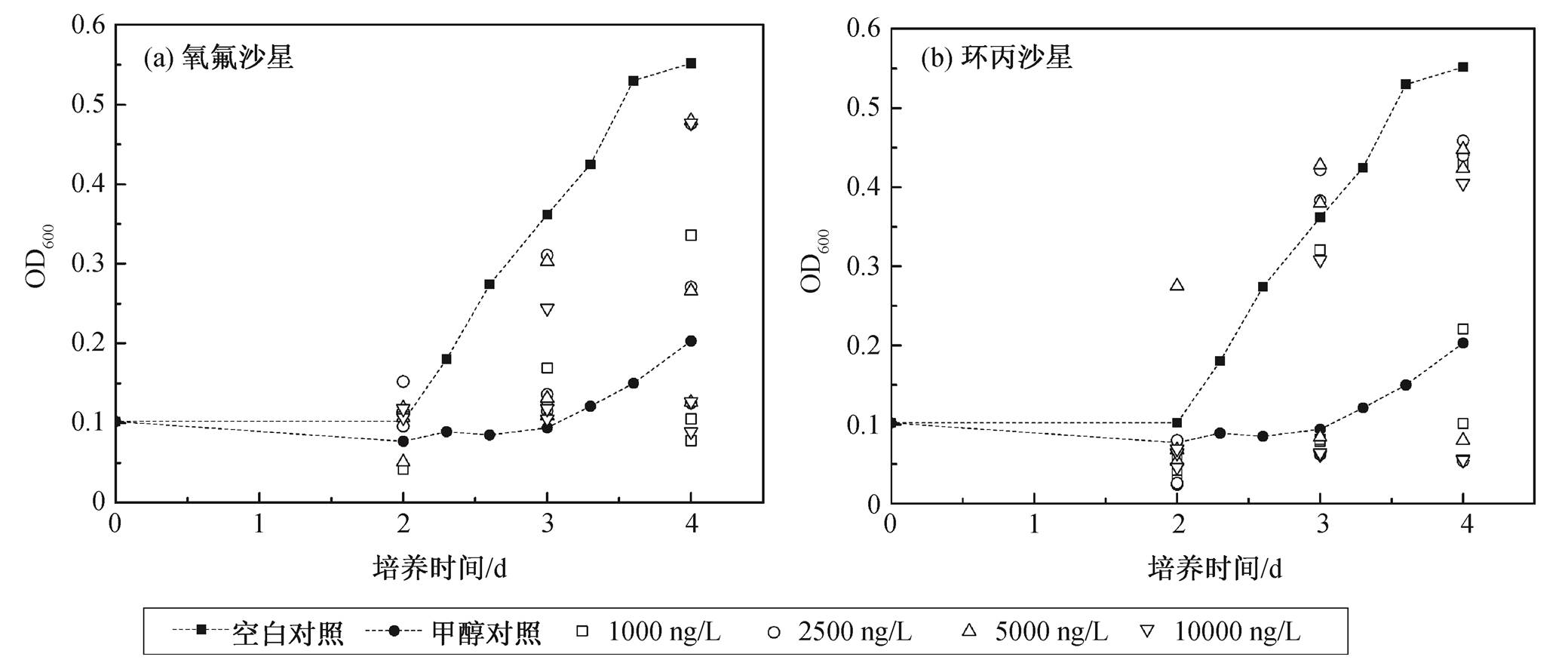
图1 不同浓度氧氟沙星和环丙沙星的添加对PCA菌生长的影响
Fig. 1 Influence of OFL and CIP on growth of PCA
陶虎春†马骉 丁凌云 吴青青 高月
深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055; † E-mail: taohc@pkusz.edu.cn
摘要以一种典型的汞甲基化细菌铁还原菌Geobacter sulphurreducensPCA为研究菌种, 选取两种喹诺酮类抗生素氧氟沙星和环丙沙星, 研究复合污染体系下抗生素对PCA菌生长和产甲基汞能力的影响。研究结果表明, 低浓度抗生素对PCA菌的生长有促进作用。通过抗生素浓度的检测以及ESI scan扫描图得出,Geobacter sulphurreducensPCA可以代谢氧氟沙星, 环丙沙星不能被Geobacter sulphurreducensPCA降解。两种抗生素的存在会促进汞甲基化发生, 氧氟沙星对于Geobacter sulphurreducensPCA甲基汞转化率的提升是对照组的4.21倍, 环丙沙星对甲基汞转化率的提升是对照组的2.27倍。添加两种抗生素的混合溶液对Geobacter sulphur-reducensPCA菌甲基汞转化率的提升也达到对照组的2倍以上, 但没有显示出两种抗生素对甲基汞转化具有协同促进作用。
关键词汞甲基化微生物; 抗生素; 代谢产物; 甲基化速率
甲基汞是一种典型的有机汞污染物, 因水俣病的发生而受到广泛关注, 其神经毒性对儿童的影响很大[1], 也是某些心脏疾病的诱发因素[2]。自然界存在的及人类活动向环境中排放的主要是二价汞离子, 它可与矿物或化石燃料中的硫酸盐较稳定地结合, 然后通过工业活动被释放进入大气, 经历一系列的地球化学循环,最终沉淀在沉积物和土壤中。沉积物和土壤中的微生物是汞甲基化的主要贡献者, 能将元素汞和无机汞转化为毒性更高的有机汞化合物[3–5]。研究表明, 一种铁还原菌Geobacter sulphurreducensPCA (PCA 菌)在存在半胱氨酸的条件下, 可以将元素汞和二价汞甲基化[6–7]。
近年来, 抗生素作为一种新兴的污染物,经不同途径进入环境。水体、沉积物和土壤等环境介质中抗生素及其活性代谢产物浓度呈升高趋势[8]。环境中残留的抗生素可抑制或促进微生物的活性, 也可对动植物产生毒性效应, 进而干扰生态功能, 威胁生态系统的稳定[9]。抗生素的微生物毒性作用呈现剂量效应[10–12]。研究表明,低浓度的抗生素无显著毒性效应[13], 相反地, 添加低剂量的抗生素可以对微生物产生刺激生长的作用[14]。
为了防治疾病、促进生长, 水产养殖业大量使用抗生素, 导致由水产养殖带入环境的抗生素不断累积[15]。针对鱼体内甲基汞浓度的调查结果表明, 可能是鱼的饲养模式导致甲基汞在鱼肉内累积[16]。进一步的研究表明, 水产养殖业的活动会增加水体中汞的负荷, 并且促进甲基汞的产生[17]。可见, 甲基汞和抗生素拥有共同的人类暴露途径, 但目前针对二者复合污染的研究较少, 有限的野外数据难以描述抗生素对汞甲基化的影响规律。
本文基于实验室纯培养体系, 研究汞甲基化细菌铁还原菌Geobacter sulphurreducensPCA与两种抗生素(氧氟沙星和环丙沙星)的相互影响, 为揭示抗生素对汞甲基化的影响规律奠定基础。
主要仪器: Agilent 1290-6460A型超高效液相色谱串联三重四级杆质谱仪(美国安捷伦公司), UV-1800型号紫外-可见分光光度计(中国上海美谱达仪器有限公司), 汞形态气相裂解模块、MODEL III型原子荧光光度计和TDM-II型解吸附模块(美国Brooks Rand公司), SHZ-82型水浴恒温振荡器(中国江苏金怡仪器有限公司), HV-25型高压灭菌锅(日本Hirayama公司)。
主要试剂: 环丙沙星、氧氟沙星和富马酸均购自北京百灵威科技有限公司, 均为分析纯(环丙沙星和氧氟沙星为98%, 富马酸为99%); 甲醇, 购自上海麦克林生化科技有限公司, 为色谱纯。
1.2.1 PCA菌培养基制备
制备Geobacter sulphurreducensPCA菌株专用培养基NBF。预先配制100X NB Salts,NB Mineral Elixir,DL Vitamins,1mmol/L Na2SeO4以及2和10 mmol/L的NaOH。配制方法如下。
100X NB Salts为非金属盐混合液。称量42 g KH2PO4, 22 g K2HPO4, 20 g NH4Cl, 38 g KCl和36 g NaCl至1 L烧杯中, 加入800 mL超纯水, 搅拌溶解后定容至1 L, 将配制好的溶液保存于4℃冰箱中。
NB Mineral Elixir为金属盐混合液。首先在1 L烧杯中加入约800 mL超纯水, 加入2.14 g NTA (氨三乙酸), 用10 mol/L NaOH调整溶液pH至6.5~7.0,改用2 mol/L NaOH调整溶液pH至8.0~8.5。在调节好pH的溶液中依次加入0.1 g MnCl2·4H2O, 0.3 g FeSO4·7H2O, 0.17 g CoCl2·6H2O, 0.2 g ZnSO4·7H2O, 0.03 g CuCl2·2H2O, 0.005 g H3BO3, 0.09 g Na2MoO4·2H2O, 0.11 g NiSO4·6H2O 以及 0.02 g Na2WO4·2H2O, 搅拌溶解, 待试剂全部溶解后, 使用超纯水定容至1 L, 4℃冰箱保存。
DL Vitamins为维生素混合液。称量0.002 g 生物素、0.005g泛酸、0.0001g维生素B-12、0.005g 对氨基苯甲酸、0.005g硫辛酸、0.005g烟酸、0.005g硫胺素、0.005g核黄素、0.01g盐酸吡哆醇和0.002g叶酸, 加入800mL超纯水, 搅拌溶解, 然后使用超纯水定容至1 L, 4℃避光保存。
NBF培养基配制: 在1L烧杯中加入约800mL超纯水, 称取4.64 g富马酸加入烧杯中, 为溶解富马酸, 用10 mol/L NaOH调节pH为6左右, 改用2 mol/L NaOH继续调节至pH最终为6.5~7.0。然后称取0.04 g CaCl2·2H2O, 0.1gMgSO4·7H2O, 1.8gNaHCO3,0.5 g Na2CO3·H2O和2.04 g NaAC·3H2O, 加入富马酸溶液中。待试剂全部溶解后, 分别加入10mL 100X NB Salts、10mLNB Mineral Elixir、15mL DL Vitamins 和1 mL 1 mmol/L Na2SeO4。搅拌后, 用超纯水定容至1L。培养基分装后, 氮吹除氧, 并在灭菌锅中灭菌后待接种。
1.2.2 PCA菌的接种和培养
选取Geobacter sulphurreducensPCA原始菌液和经分装吹氮灭菌的NBF培养基, 用沾有70%乙醇的医用棉花分别在原始菌种和厌氧培养管的橡胶套处消毒, 用1 mL医用注射器接种体积比为6.25%的原始菌种。将接种好的厌氧培养管贴上标签, 置于避光恒温水浴摇床中培养。
测定细胞浓度时, 先用70%乙醇将厌氧培养管管口消毒, 然后取1 mL菌液放入1 mL比色皿中,利用紫外分光光度计测定OD600值, 分析细菌的生长情况。
1.2.3 甲基汞检测
采用蒸馏-乙基化-GC-CAVFS法[18]对甲基汞进行检测。取2mL水样混合酸化后,加入蒸馏瓶定容至45mL。连接蒸馏装置后, 在接收瓶中加入约5 mL蒸馏水。蒸馏2.5小时左右, 取接收瓶中溶液定容至50mL待测。取蒸馏后的样品1mL,加入装有100mL左右蒸馏水的吹烧瓶中, 连接干燥管和Tenax管后,加入40 μL四乙基硼化钠与甲基汞发生烷基化反应, 形态汞被氮气吹扫出溶液, 然后传输到Tenax管上富集。最后, 形态汞通过热脱附进入气相色谱柱进行分离, 从气相分离出来的组分通过一个热裂解柱进行热解析。热解析后, 所有组分还原为汞蒸汽, 进入原子荧光检测器进行检测。
1.2.4 抗生素及其代谢产物的检测
采用超高效液相色谱串联三重四级杆质谱仪(Agilent 1290-6460A)对氧氟沙星和环丙沙星的浓度和代谢产物进行分析, 测量方法的建立与相关数据的处理参考文献[19]。取2mL样品, 经过离心后, 过0.22μm有机相针式滤器待测。在进样小瓶中加入样品和20ng/g的环丙沙星D8作为内标,定容至1 mL。采用电喷雾离子源正模式-母离子全扫描图对抗生素代谢产物进行定量分析。
为探究两种抗生素对PCA菌生长初期的影响, 在厌氧培养管内有8mL培养基中接种PCA菌的同时, 添加氧氟沙星(OFL)和环丙沙星(CIP), 其浓度梯度均选取1000, 2500, 5000和10000 ng/L。考察纯培养体系条件下, 该浓度梯度的抗生素对PCA菌生长情况的影响。抗生素的溶解采用甲醇作为有机溶剂, 为保证PCA菌接种前的厌氧和无菌条件, 未吹干甲醇。实验组除每个浓度梯度抗生素外, 加入80 μL甲醇的培养基作为甲醇对照组, 不加甲醇的培养基作为空白对照组, 每组均采用3个平行样, 以使消除菌种生长造成的差异。不同处理组对细菌生长的影响如图1所示。
空白对照组在两天左右开始进入细菌的对数生长期, 并在随后的两天中逐渐进入平稳的稳定期。与空白对照组相比, 甲醇对照组PCA菌的生长明显存在一定程度的延迟。添加甲醇的实验组, 第3天才开始缓慢生长, 且OD600值在第4天远远低于空白对照组, 说明甲醇对微生物生长有明显的抑制作用。
尽管空白对照组和甲醇对照组的3个平行样之间生长情况相似, 但实验组平行样的生长情况差异较大, 难以取平均数制成生长曲线。图1中空心符号点显示在两种抗生素影响下PCA菌的生长情况。对比同时期甲醇对照组的细胞浓度, 大部分实验组的数据均高于甲醇对照组, 但低于空白对照组, 可见在甲醇对微生物存在明显的抑制作用情况下, 抗生素的添加起到了促进微生物生长的作用。在实验浓度范围内, 4个浓度梯度的抗生素对PCA菌的生长没有呈现梯度性的影响。

图1 不同浓度氧氟沙星和环丙沙星的添加对PCA菌生长的影响
Fig. 1 Influence of OFL and CIP on growth of PCA

图2 抗生素对平稳期PCA菌的影响
Fig. 2 Influence of antibiotics on stationary growth of PCA
为了验证抗生素对PCA菌生长稳定期的影响, 选取4个装有600 mL培养基的厌氧培养瓶接种已生长至稳定期的PCA菌, Q1为空白对照组, Q2添加 浓度梯度为5000 ng/L的氧氟沙星, Q3添加浓度梯度为5000 ng/L的环丙沙星, Q4添加浓度梯度为5000 ng/L的氧氟沙星和环丙沙星混合溶液, 培养10天。结果如图2所示。
经10天的培养, 所有实验组的OD600值下降0.057~0.079, 基本上符合有限培养基体积稳定期菌体浓度的变化趋势。可见, 在5000 ng/L浓度条件下, 氧氟沙星和环丙沙星对稳定期PCA菌生长的影响不大。
为探究PCA菌对氧氟沙星和环丙沙星的降解情况, 选取4个浓度梯度: 1000 ng/L (A组), 2500 ng/L (B组), 5000 ng/L (C组)和10000 ng/L (D组)。通过检测接种时以及对数生长期2天时的抗生素浓度, 初步判断PCA菌对抗生素的降解情况, 结果如图3所示。
A组的3个平行样未检出氧氟沙星, 可能是由于剩余氧氟沙星的量较少, 未达到仪器的检测限, 可以认为已经被细菌全部降解完成, 因此降解效率达到100%; B组降解效率为78.08%, C组和D组降解效率分别为58.40%和59.81%。可以看出, 细菌可以较好地代谢氧氟沙星, 氧氟沙星可能作为细菌生长的某种营养物质促进细菌的生长。随着初始添加浓度的增大, 氧氟沙星的代谢率逐渐降低, 并稳定在60%左右。
环丙沙星的降解实验表明, 在对数生长期, 环丙沙星浓度与开始添加的浓度相比, 没有显著减少, B,C和D组浓度值甚至高于初始浓度, 可以认为环丙沙星没有被细菌有效降解。
为进一步证明PCA可以分解氧氟沙星, 我们对氧氟沙星被PCA菌降解的代谢产物进行电喷雾离子源正模式-母离子全扫描图分析, 定性地分析代谢产物, 结果如图4所示。为排除培养基中过多的物质对结果分析造成的干扰, 采用空白培养基的全扫描图作为对照组, 对比氧氟沙星自然水解和被PCA菌代谢后全扫描图的异同。
氧氟沙星的离子结构为[M+H]+, ESI scan峰在m/z为362附近。代谢后可能的离子结构及代谢产物推断参照文献[20-22]。
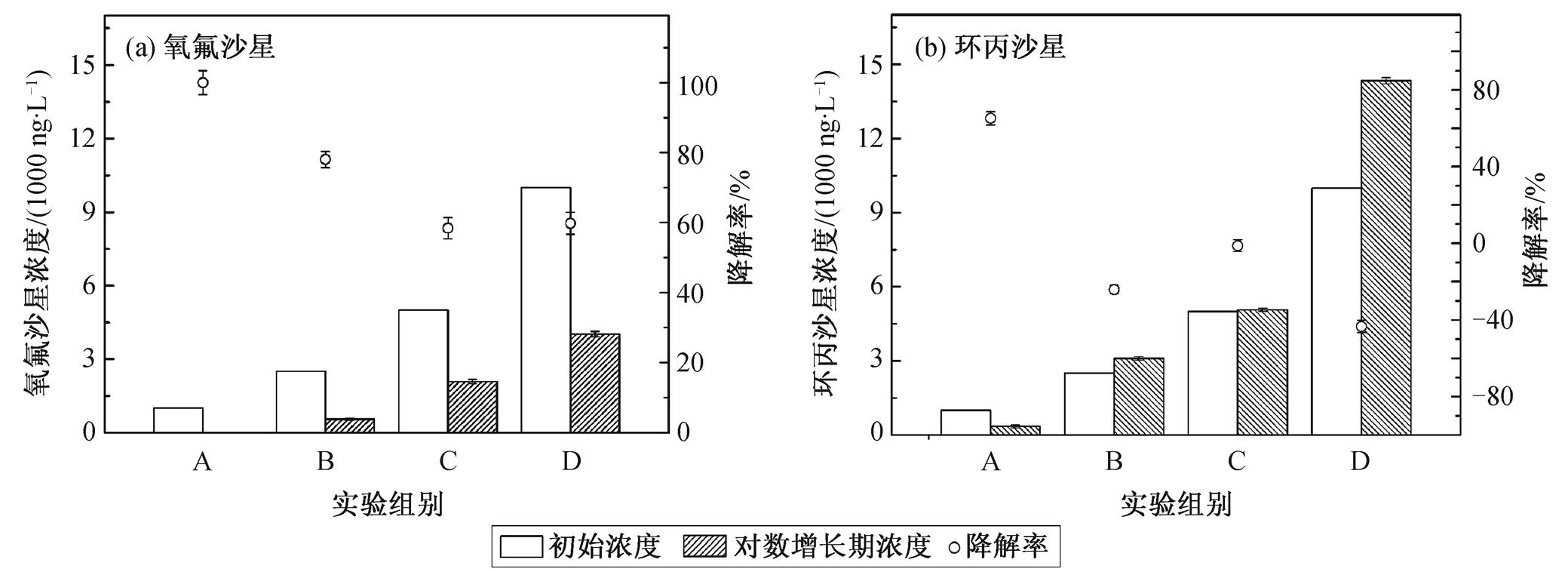
图3 PCA菌对氧氟沙星和环丙沙星的降解
Fig. 3 Degradation of OFL and CIP by PCA
图4(c)为氧氟沙星自然水解7天后的全扫图; 图4(d)为PCA菌培养两天后降解氧氟沙星的全扫图(PCA菌OD600为0.152时开始测量, 随后2天内OD600达到0.476)。在排除培养基的干扰后, 通过图4(b)和(c)中氧氟沙星在超纯水中的降解, 可以得知氧氟沙星在水中降解主要生成m/z为205的峰(对应的离子结构推断为[M+H-CO2-C3H7N-C3H4O]+ [21])和m/z为340.3的峰(推断分子式为[C18H34N3O3]+[22])。对比图4(a)培养基的扫描图可以得知,这两个峰为氧氟沙星在水中降解的特异峰, 不受培养基的干扰, 且不是氧氟沙星m/z为318和261的特征碎片峰。在图4(d)中, 可以观察到m/z为205和340.3的峰, 因此证明氧氟沙星在细菌的培养过程中发生了降解。以往研究主要关注氧氟沙星的光和催化剂降解, 本实验中细菌的培养条件是避光, 因此可以认为上述两个峰为细菌对氧氟沙星的降解产物峰。
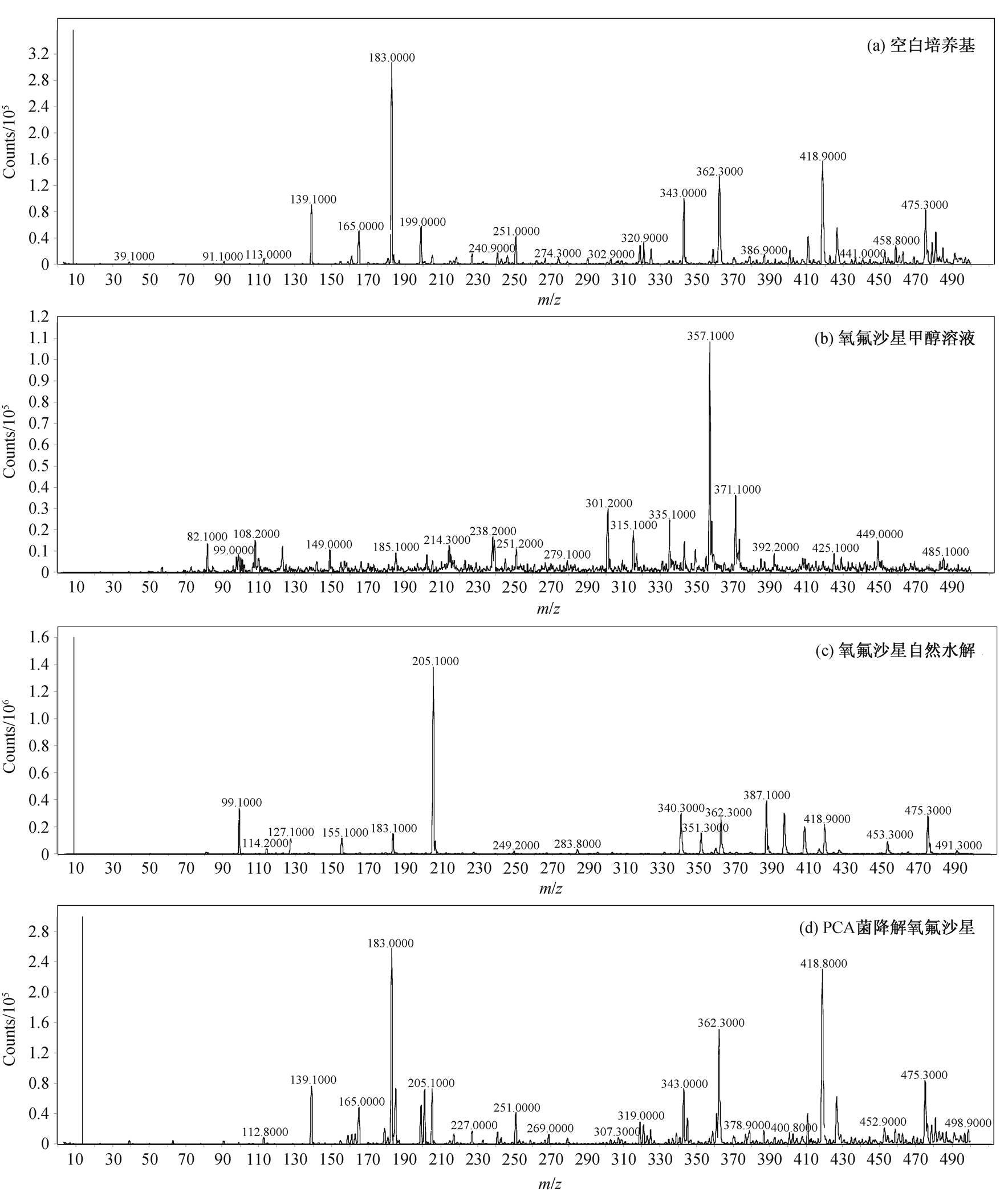
图4 空白培养基、氧氟沙星甲醇溶液、氧氟沙星自然水解和PCA菌降解氧氟沙星的电喷雾离子源正模式-母离子全扫描图
Fig. 4 ESI scan of blank substrate, OFL, natural hydrolysis of OFL and degradation by PCA
为验证抗生素对PCA菌产生甲基汞能力的影响, 选取4个装有600 mL培养基的厌氧培养瓶接种已生长至稳定期的PCA菌, 均加入5000 ng/L氯化汞和50 μmol/L的半胱氨酸[7], 分为无抗生素的对照组Q1、添加5000 ng/L氧氟沙星Q2、添加5000 ng/L环丙沙星Q3以及添加5000 ng/L氧氟沙星和环丙沙星的混合溶液Q4, 为期10天连续采样, 检测反应器中甲基汞的浓度, 结果如图5所示。
从图5可以看出,所有添加抗生素实验组的甲基汞浓度均超过未添加抗生素的对照组,所以, 氧氟沙星和环丙沙星对Geobacter sulphurreducensPCA汞的生物甲基化有较明显的促进作用。仅对比两种不同抗生素添加的曲线可知, 氧氟沙星的促进能力超过环丙沙星。结合2.4节的研究结果可知, 氧氟沙星可以被Geobacter sulphurreducensPCA菌代谢分解, 因此, 氧氟沙星可能作为细菌的某种营养物质或者甲基化过程的某种促进物质被细菌代谢, 促进汞甲基化的进程, 甲基汞的转化率提升, 达到对照组的4.21倍。环丙沙星也促进细菌的汞甲基化, 甲基汞转化率提升达到对照组的2.27倍, 但提升幅度并没有超过氧氟沙星。由于环丙沙星不能被细菌代谢, 其实际作用方式有待进一步探索。研究表明, 可溶性有机物可能起到转运分子的作用或与汞结合转运进细胞内作为碳源[23], 所以推测环丙沙星可能起到转运分子的作用。
从图6也可以看出, 混合抗生素实验组的转化率不如只添加氧氟沙星的实验组, 但与添加环丙沙星的实验组相近。添加混合抗生素实验组的汞甲基化能力接近添加环丙沙星实验组的提升幅度。原因可能是当氧氟沙星和环丙沙星同时存在时, 形成某种聚合体, 从而影响细菌对氧氟沙星的降解吸收, 但保留了环丙沙星对氯化汞或者甲基汞的主动运输。
本文采用实验室纯培养体系, 研究了氧氟沙星和环丙沙星对Geobacter sulphurreducensPCA的剂量效应。建立了两种抗生素及其代谢产物的检测方法, 利用质谱扫描图分析了两种抗生素的生物降解产物, 进而评估两种抗生素对汞生物甲基化能力的影响, 为汞和抗生素复合污染的探索提供了参考数据。本研究得到以下结论。
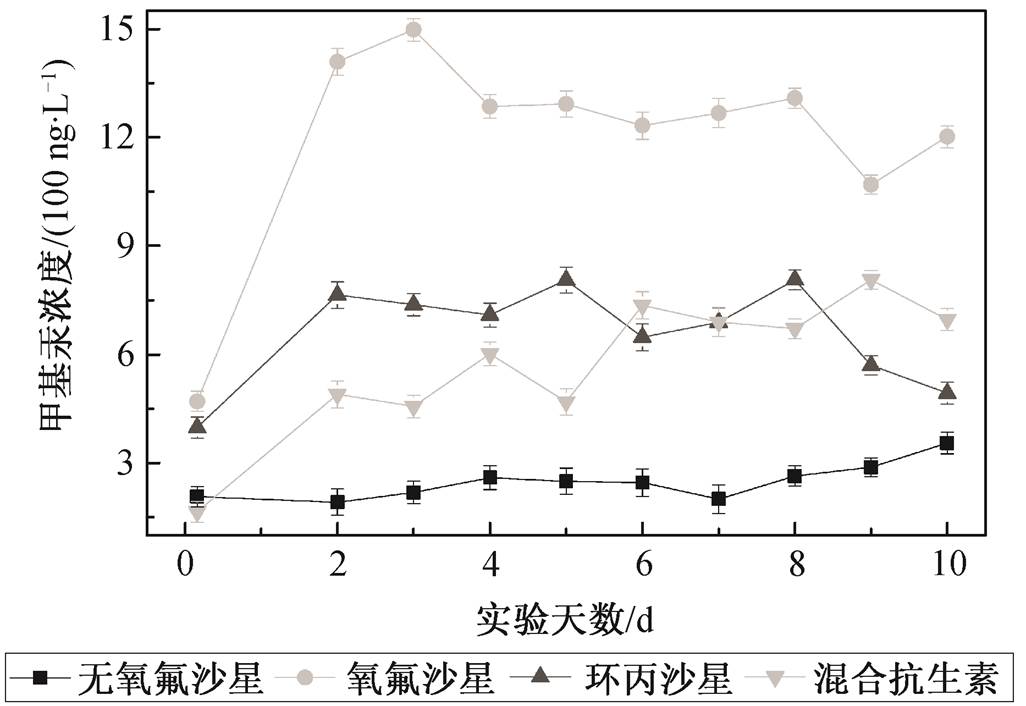
图5 两种抗生素对甲基汞浓度的影响
Fig. 5 Influence of two antibiotics on concentration of mercury methylation
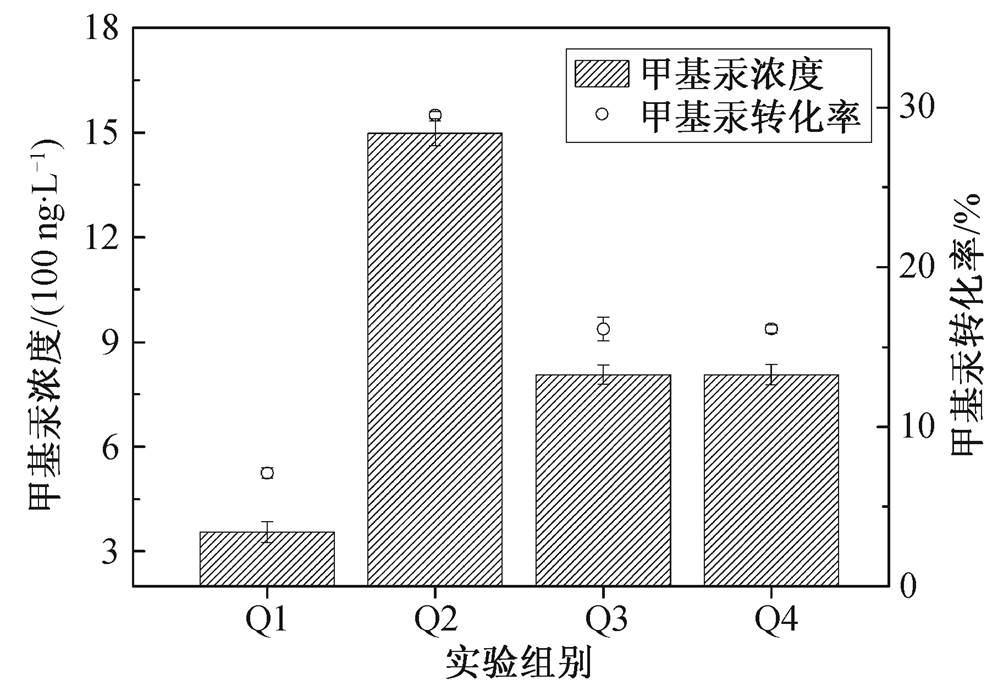
图6 10天内最高甲基汞转化效率
Fig. 6 Highest rate of mercury methylation in 10 d
1)浓度在10000 ng/L以下的氧氟沙星和环丙沙星会促进Geobacter sulphurreducensPCA的生长。
2)通过抗生素浓度的检测和ESI scan扫描图, 得出Geobacter sulphurreducensPCA可以代谢氧氟沙星的结论。环丙沙星不能被Geobacter sulphurre-ducensPCA显著降解。
3)在实验条件下, 氧氟沙星对Geobacter sul-phurreducensPCA甲基汞的转化率的提升幅度达到对照组的4.21倍, 环丙沙星对甲基汞转化率的提升幅度达到对照组的2.27倍。
4)通过添加两种抗生素的混合溶液, 发现对Geobacter sulphurreducensPCA菌甲基汞转化率的提升幅度也达到对照组的2倍以上, 接近环丙沙星的作用。两种抗生素没有形成甲基汞的协同促进转化。
参考文献
[1]Bittner A C, Echeverria D, Woods J S, et al. Beha- vioral effects of low-level exposure to Hg0among dental professionals: a cross-study evaluation of psychomotor effects. Neurotoxicology and Teratology, 1998, 20(4): 429–439
[2]Harada M, Nakanishi J, Konuma S, et al. The present mercury contents of scalp hair and clinical symptoms in inhabitants of the Minamata area. Environmental Research, 1998, 77(2): 160–164
[3]Berman M, Bartha R. Levels of chemical versus biological methylation of mercury in sediments. Bul-letin of Environmental Contamination and Toxicology, 1986, 36(3): 401–404
[4]Celo V, Lean D R S, Scott S L. Abiotic methylation of mercury in the aquatic environment. Science of the Total Environment, 2006, 368(1): 126–137
[5]Goldwater L. Human toxicology of mercury. Journal of Trace Elements in Experimental Medicine, 1998, 11(2/3): 165–175
[6]胡海燕, 顾宝华, 冯新斌. 厌氧微生物对汞的氧化、还原和甲基化作用 // 第七届全国环境化学大会. 贵阳, 2013: 16
[7]Hu H, Lin H, Zheng W, et al. Oxidation and methy-lation of dissolved elemental mercury by anaerobic bacteria. Nature Geoscience, 2013, 6(9): 751–754
[8]Halling-Sorensen B, Nielsen S N, Lanzky P F, et al. Occurrence, fate and effects of pharmaceutical sub-stances in the environment — a review. Chemosphere, 1998, 36(2): 357–394
[9]Li W C. Occurrence, sources, and fate of pharma-ceuticals in aquatic environment and soil. Environ-mental Pollution, 2014, 187: 193–201
[10]Thiele-Bruhn S. Microbial inhibition by pharmaceuti-cal antibiotics in different soils-dose-response rela-tions determined with the iron (III) reduction test. Environmental toxicology and chemistry, 2005, 24(4): 869-876
[11]Kong W D, Zhu Y G, Fu B J, et al. The veterinary antibiotic oxytetracycline and Cu influence functional diversity of the soil microbial community. Environ-mental Pollution, 2006, 143(1): 129–137
[12]Kotzerke A, Hammesfahr U, Kleineidam K, et al. In-fluence of difloxacin-contaminated manure on micro-bial community structure and function in soils. Biology and Fertility of Soils, 2011, 47(2): 177–186
[13]Thiele-Bruhn S, Beck I. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass. Chemosphere, 2005, 59(4): 457–465
[14]Dantas G, Sommer M O A, Oluwasegun R D, et al. Bacteria subsisting on antibiotics. Science, 2008, 320: 100–103
[15]胡梦红. 抗生素在水产养殖中的应用、存在的问题及对策. 水产科技情报, 2006, 33(5): 217–221
[16]Liang P, Gao X, You Q, et al. Role of mariculture in the loading and speciation of mercury at the coast of the East China Sea. Environmental Pollution, 2016, 218: 1037–1044
[17]Tao H C, Zhao K Y, Ding W Y, et al. The level of mercury contamination in mariculture sites at the estuary of Pearl River and the potential health risk. Environmental Pollution, 2016, 219: 829–836
[18]蒋红梅, 冯新斌, 梁琏, 等. 蒸馏-乙基化 GC-CVAFS 法测定天然水体中的甲基汞. 中国环境科学, 2004, 24(5): 568–571
[19]Zhou L J, Ying G G, Liu S, et al. Simultaneous determination of human and veterinary antibiotics in various environmental matrices by rapid resolution liquid chromatography-electrospray ionization tandem mass spectrometry. Journal of Chromatography A, 2012, 1244: 123–138
[20]Xie R, Meng X, Sun P, et al. Electrochemical oxide-tion of ofloxacin using a TiO2-based SnO2-Sb/poly-tetrafluoroethylene resin-PbO2, electrode: reaction kinetics and mass transfer impact. Applied Catalysis B Environmental, 2016, 203: 515–525
[21]D’Agostino P A, Hancock J R, Provost L R. Elec-trospray mass spectrometric characterization of fluo-roquinolone antibiotics: norfloxacin, enoxacin, cipro-floxacin and ofloxacin. Rapid Communications in Mass Spectrometry, 2010, 9(11): 1038–1043
[22]Jimenez-Villarin J, Serra-Clusellas A, Martínez C, et al. Liquid chromatography coupled to tandem and high resolution mass spectrometry for the characteri-sation of ofloxacin transformation products after titanium dioxide photocatalysis. Journal of Chroma-tography A, 2016, 1443: 201–210
[23]Mazrui N M, Jonsson S, Thota S, et al. Enhanced availability of mercury bound to dissolved organic matter for methylation in marine sediments. Geochi-mica et Cosmochimica Acta, 2016, 194: 153–162
Influence of Two Quinolone Antibiotics on Mercury Methylation Bacteria ofGeobacter sulphurreducensPCA
TAO Huchun†, MA Biao, DING Lingyun, WU Qingqing, GAO Yue
Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; † E-mail: taohc@pkusz.edu.cn
AbstractUsing one kind of main mercury methylation iron reducing bacteria ofGeobacter sulphurreducensPCA strains as targeting bacteria, two kinds of quinolones ciprofloxacin and ofloxacin were chosen to study the influence of antibiotics on PCA strains and its ability to methylate mercury in combined pollution. The experiment results showed that a promoting effect of antibiotics on growth PCA was found under the low concentration. Through the detection of the concentration of antibiotic and the figure of ESI scan, it was found thatGeobacter sulphurreducens PCA could metabolize ofloxacin, but ciprofloxacin could not be degraded byGeobacter sulphurreducensPCA. Methylation of mercury was promoted by the presence of two kinds of antibiotics, the methyl-mercury conversion rate of ofloxacin toGeobacter sulphurreducensPCA was 4.21 times higher than that of the control group, ciprofloxacin was 2.27 times, and the addition of two mixed kinds of antibiotics was nearly 2 times respectively. In the mixed solution, there is no superimposed effect of methyl-mercury.
Key wordsmercury methylation microorganisms; antibiotics; metabolite; methylation rate
中图分类号X703
doi:10.13209/j.0479-8023.2018.016
国家自然科学基金(51679002)、深圳市基础研究项目(JCYJ20160330095549229, JCYJ20170306092248830)和流域生态工程学学科建设资金(深发改[2017]542号)资助
收稿日期:2017-05-25;
修回日期:2017-06-01;
网络出版日期:2018-06-08