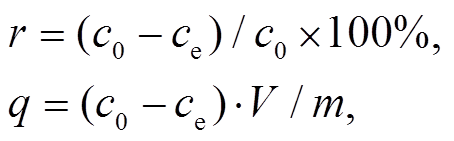
陶虎春 † 李硕 张丽娟 李金波 阳赛
北京大学深圳研究生院环境与能源学院, 深圳市重金属污染控制与资源化重点实验室, 深圳 518055
摘要 以海藻酸钠水凝胶为骨架, 结合壳聚糖和磁性Fe 3 O 4 , 开发出一种新型的磁性壳聚糖/海藻酸钠复合凝胶球(MCSB)制备方法, 并通过正交试验和单因素实验, 探究不同制备条件对复合凝胶球制备效果的影响, 确定最优制备条件: CaCl 2 浓度为 2.5g/L, 海藻酸钠浓度为 24g/L, 壳聚糖添加量为 5g/L, 磁流体添加量为 4.64g/L。制备出的凝胶球表面光滑, 大小均匀, 纯黑色, 呈球形, 直径在2mm左右, 具有顺磁性。通过傅里叶变换红外光谱(FTIR)、同步热分析(TGA)等手段对凝胶球进行表征。结果表明, MCSB 的热稳定性良好, 凝胶球表面的活性基团主要有羟基、氨基、羧基等。吸附性能实验表明, 当MCSB用量为 20mg时, 对 40mL 25 mg/LCu 2+ 溶液的吸附去除率为 78.13%, 表明磁性壳聚糖/海藻酸钠复合凝胶球是一种制备简单、效果良好的新型复合吸附剂。
关键词 海藻酸钠凝胶球; 壳聚糖; 磁性Fe 3 O 4 ; Cu 2+
电镀、石油炼制和金属冶炼等行业的重金属废水排入水体, 会对水生生物造成严重损害, 甚至危及人类健康。传统的治理技术包括化学沉淀法、植物修复法、膜处理法等 [1] 。吸附法具有操作简便、工艺周期短、治理效果好等优势, 工业化应用潜力巨大 [2] 。吸附法的核心在于吸附剂的选择, 优质的吸附剂能够降低处理工艺的前期投资和运营成本, 提高处理效果。各类吸附剂的种类繁多, 性能各异, 传统吸附剂有活性炭、各类基质制成的多孔沸石、蒙脱石、生物炭、膨润土、粉煤灰等 [3–6] 。
壳聚糖和海藻酸钠是天然的高分子有机物质, 能够有效地去除水中重金属。海藻酸钠的亲水性很强, 能够与水溶液中的钙发生离子交换反应, 并聚合形成性质稳定的水性凝胶球。这一成球特性使其能够作为一种制备复合吸附剂的理想骨架 [7–9] 。壳聚糖虽然具有吸附重金属的能力, 但单独作为吸附剂使用时, 存在耐酸性差、质量密度小、随水体易流失、稳定性差等问题 [10–12] 。所以, 将海藻酸钠与壳聚糖结合, 制备成一种复合吸附剂后, 可达到增强吸附性能的效果, 同时具备来源广泛、成本廉价、绿色安全等优势。
另一方面, 将磁性Fe 3 O 4 纳米颗粒添加到传统吸附材料中, 可以使传统吸附剂具有磁性, 解决传统吸附剂不易与水体分离, 难以回收的缺点。在外加磁场下, 吸附剂能与水体迅速分离、不会对环境造成二次污染, 使得传统吸附剂在赋磁后有了更大的应用空间 [1 3 –1 7 ] 。
本文探索出一种新型磁性壳聚糖/海藻酸钠复合凝胶球吸附剂的制备方法, 通过分析磁性四氧化三铁、壳聚糖、海藻酸钠对凝胶球制备的影响, 确定最优的制备条件, 并对复合凝胶球的吸附性能进行研究, 研究结果对新型高效吸附剂的开发具有借鉴意义。
主要试剂: 海藻酸钠, 购自上海青析化工科技有限公司; 壳聚糖, 购自国药集团化学试剂有限公司; 三氯化铁, 购自天津市福晨化学试剂厂; 氯化钙、氯化亚铁、氨水和硫酸铜均购自天津市大茂化学试剂厂。所有试剂均为分析纯。
主要仪器: 振动磁强计(VSM Lake Shore 7307), 美国Lake Shore公司; 傅里叶变换红外光谱仪(Nicolet 6700), 赛默飞世尔科技公司; 激光粒度仪(Mastersizer3000), 英国Malvern公司; 原子吸收分光光度计(TAS-990), 北京普析通用仪器有限责任公司; PH计(IE438), 瑞士Mettler公司; 同步热分析仪(STA 409PC), 德国NETZSCH。
根据Fakhrullin等 [18] 的方法, 采用共沉淀法制备磁性Fe 3 O 4 纳米颗粒。向烧杯中加入 20mL1mol/L FeCl 3 溶液和20 mL 0.5 mol/L FeCl 2 溶液, 边搅拌边加入25%的氨水, 至有黑色沉淀物大量析出。磁分离后, 弃上清液, 再用超纯水洗涤黑色沉淀物, 重复数次至上清液的pH接近中性。收集全部黑色沉淀物, 重新悬浮于超纯水中, 定容至100mL容量瓶中, 即得Fe 3 O 4 纳米磁流体。
取海藻酸钠溶液20mL于烧杯中, 同时加入壳聚糖粉末和前述的Fe 3 O 4 纳米磁流体, 搅拌混合后超声波处理 5 分钟。用 1 mL规格的注射器针管, 将混合液缓慢匀速滴入CaCl 2 溶液中。混合液在水中交联, 形成大小均匀的复合凝胶球。在CaCl 2 溶液中浸泡成化一定的时间后, 取出凝胶球, 用超纯水洗涤3次, 即得磁性壳聚糖/海藻酸钠复合凝胶球。
凝胶球的优化过程分为两步, 先通过正交试验, 确定各种因素的影响程度和作用范围, 根据实验结果, 确定CaCl 2 浓度、海藻酸钠浓度、壳聚糖添加量和磁流体添加量为制备复合凝胶球最重要的4个影响因素。在此基础上, 分别采用单因素实验进行研究, 比较不同条件下制备的复合凝胶球对水中Cu 2+ 的吸附性能(Cu 2+ 溶液的初始浓度为25mg/L, 凝胶球用量为20mg), 最终确定复合凝胶球的最优制备条件。
1.4.1 磁流体制备效果
使用激光粒度仪(Malvern, Mastersizer3000)测量磁流体的颗粒大小和粒径分布。在25ºC的室温下, 使用振动磁强计(Lake Shore, VSM 7307)测量磁流体的饱和磁化强度, 测量时的外加磁场范围为 –1.5~1.5 T。
1.4.2 热失重分析
采用同步热分析仪(NETZSCH, STA 409PC), 对不同壳聚糖和磁流体添加量凝胶球的热失重过程进行对比分析, 温度变化范围是0~600ºC, 加热过程在纯氮气保护下实施。对壳聚糖添加量不同而其他条件为最优条件的凝胶球, 按照壳聚糖的添加梯度5, 10和15g/L分别记为5CTS-MCSB, 10CTS-MCSB和15CTS-MCSB。对磁流体添加量不同而其他条件为最优条件的另一组凝胶球, 按照磁流体的添加梯度2.32, 4.64和6.96g/L, 分别记为2.32Fe-MCSB, 4.64Fe-MCSB和6.96Fe-MCSB。
1.4.3 红外光谱分析
采用傅里叶变换红外光谱仪(Thermo-Nicolet, Nicolet 6700), 对不同凝胶球表面可能存在的活性基团进行对比分析, 采用溴化钾压片法进行测量, 波数变化范围为4000~400cm –1 。按照最优条件制备的凝胶球记为MCSB, 未添加壳聚糖而其他条件为最优条件的凝胶球记为MSB, 未添加磁流体而其他条件为最优条件的凝胶球记为CSB。
1.5.1 不同凝胶球用量对吸附的影响
将CuSO 4 溶解于超纯水中, 配置40mL 25mg/L Cu 2+ 溶液。加入不同用量的磁性壳聚糖/海藻酸钠凝胶球, 置于恒温振荡器中, 以220r/min的速率振荡吸附3小时后, 用磁铁吸引磁性凝胶球实现固液分离, 用火焰原子吸收法测量剩余溶液中Cu 2+ 的浓度, 每组实验重复3次, 并计算吸附剂的吸附去除率和吸附量, 计算公式 [19] 如下:
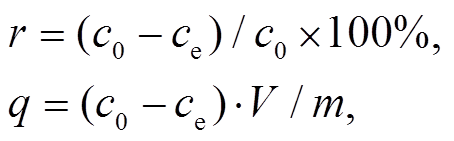
式中, r 为Cu 2+ 的吸附去除率, c 0 为Cu 2+ 溶液的初始浓度(mg/L), c e 为Cu 2+ 溶液的吸附后浓度(mg/L), q 为吸附剂的吸附量(mg/g), V 为溶液的总体积(mL), m 为吸附剂的量(mg)。
1.5.2 不同溶液pH对吸附的影响
将CuSO 4 溶解于超纯水中, 配置40mL25mg/L Cu 2+ 溶液, 加入20mg磁性壳聚糖/海藻酸钠凝胶球, 用盐酸、氢氧化钠溶液调节溶液pH为1, 2, 3, 4, 5和6, 置于恒温振荡器中, 以220r/min的速率振荡吸附3小时后, 用磁铁吸引磁性凝胶球实现固液分离, 用火焰原子吸收法测量剩余溶液中Cu 2+ 的浓度, 每组实验重复3次, 用上述公式计算吸附剂的吸附去除率和吸附量。
为了验证磁性Fe 3 O 4 纳米颗粒的制备效果, 对其进行磁性能测试和比表面积分析, 其饱和磁化强度、粒径分布和比表面积如表1所示。磁性Fe 3 O 4 纳米颗粒的饱和磁化强度为64.0emu/g, 达到较高的磁化强度水平, 同时剩余磁化强度和矫顽力均为0, 表现出明显的超顺磁性。粒径中值 D v (50)为42.2nm, 表示粒径最小值的前10%的 D v (10)为17.1nm, 绝大部分的磁性Fe 3 O 4 纳米颗粒粒径小于100nm。同时, 磁性Fe 3 O 4 纳米颗粒的比表面积为168.7m 2 /g。这些结果表明制备的磁性Fe 3 O 4 纳米颗粒性能良好, 能够满足赋磁要求。
海藻酸钠具有独特的成球性, 可以在CaCl 2 溶液中发生反应, 通过离子交换形成水凝胶, 并可以通过改变环境条件控制凝胶球的直径和机械强度。因此, CaCl 2 浓度会对MCSB的吸附性能产生影响。从图 1 可以看出, 对于25mg/L的Cu 2+ 溶液, 随着CaCl 2 浓度的不断增加, MCSB对水中Cu 2+ 的吸附去除率呈不断下降的趋势, MCSB的吸附性能不断降低。由于在较高的CaCl 2 浓度下, 水中的钙离子含量过多, 除作为骨架支撑海藻酸钠而形成水凝胶外, 过量的钙离子也占用部分海藻酸钠吸附Cu 2+ 的吸附点位, 使得MCSB吸附能力有所降低。因此, 在保证MCSB具有一定的机械强度后, 应选择浓度相对较小的CaCl 2 溶液来制备MCSB, 最优的CaCl 2 浓度为2.5 g/L。
表1 磁性Fe 3 O 4 纳米颗粒的制备效果
Table 1 Magnetism, size distribution and specific surface area of magnetic Fe 3 O 4 nanoparticles

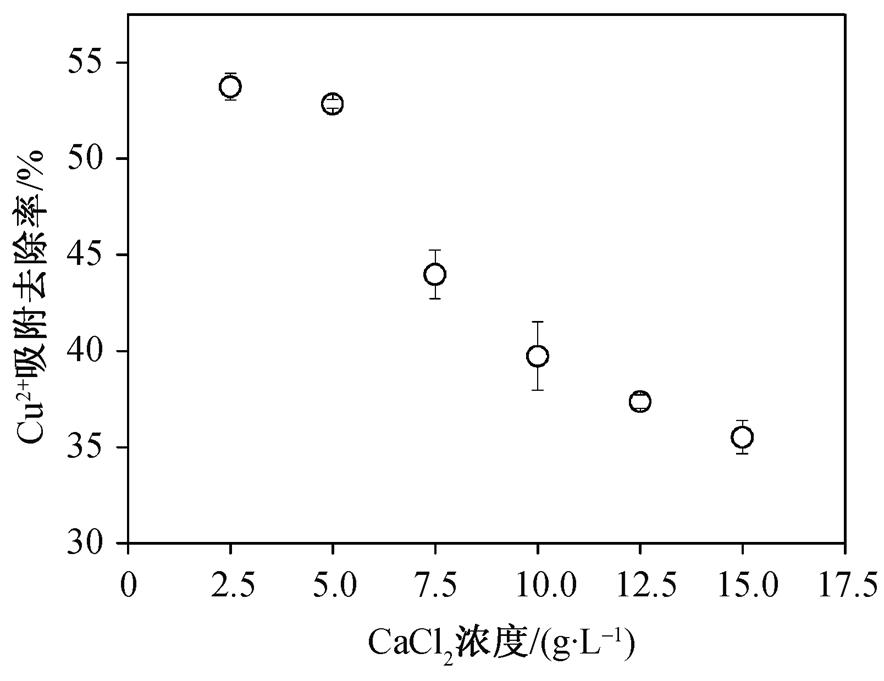
图1 CaCl 2 浓度对MCSB吸附性能的影响
Fig. 1 Effect of CaCl 2 concentration on adsorption capacity of MCSB
海藻酸钠是一类天然的高分子有机物, 具有较强的吸附重金属的能力, 不同的海藻酸钠浓度会影响MCSB的吸附性能。从图 2 可以看出, 对于25 mg/L的Cu 2+ 溶液, 随着海藻酸钠浓度的不断增加, MCSB的Cu 2+ 吸附性能先增加然后不断下降。当海藻酸钠浓度达到 24 g/L时, MCSB 对水中Cu 2+ 的吸附去除率达到最高值68.51%。这是由于随着海藻酸钠的浓度增加, 在凝胶球表面提供了更多可以与重金属Cu 2+ 结合的吸附位点, 增强了MCSB的吸附性能。但随着海藻酸钠浓度增大, 部分海藻酸钠的有效吸附位点被包裹在凝胶球内部, 无法与水中的Cu 2+ 接触并结合, MCSB的吸附性能开始逐渐下降。因此, 最优的海藻酸钠浓度为24 g/L。
本文将壳聚糖与海藻酸钠相结合来制备复合吸附剂, 通过两种物质之间的相互促进, 提高了复合吸附剂整体的吸附性能。不同的壳聚糖添加量对MCSB的吸附性能会产生不同的影响。从图 3 可以看出, 对于25mg/L的Cu 2+ 溶液, 未添加壳聚糖时, MCSB对水中Cu 2+ 的吸附去除率为54.91%。当壳聚糖浓度达到2.5g/L后,MCSB对水中Cu 2+ 的吸附去除率迅速上升至63.82%, 说明壳聚糖的添加显著提高了MCSB复合吸附剂的吸附性能。随着壳聚糖添加量的增加, MCSB对水中Cu 2+ 的吸附去除率先迅速增加, 然后缓慢下降。当壳聚糖的添加量为5 g/L时, MCSB 达到最强的Cu 2+ 吸附性能, 对水中Cu 2+ 的吸附去除率为 66.91%。因此, 选取最优的壳聚糖添加量为 5 g/L。
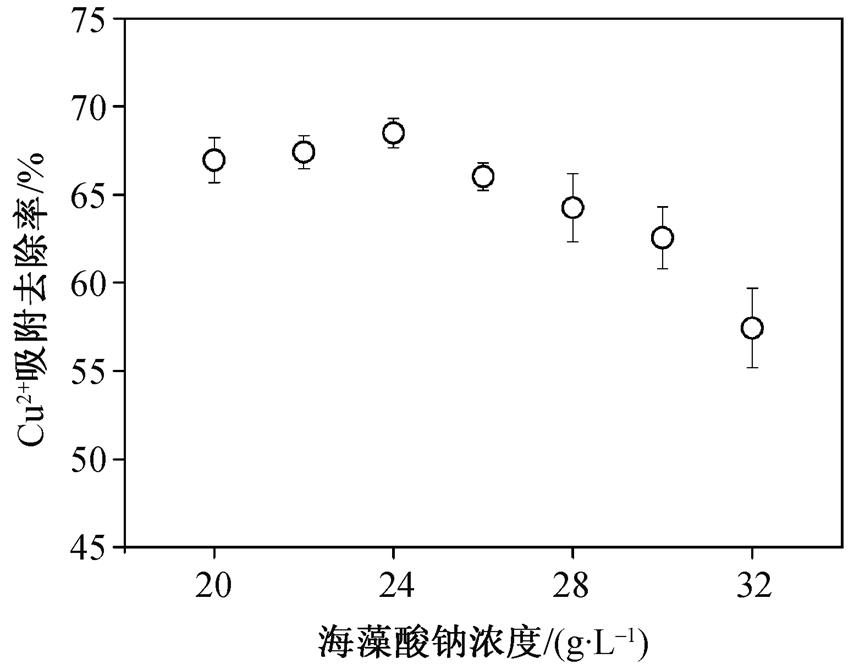
图2 海藻酸钠浓度对MCSB 吸附性能的影响
Fig. 2 Effect of SA concentration on adsorption capacity of MCSB
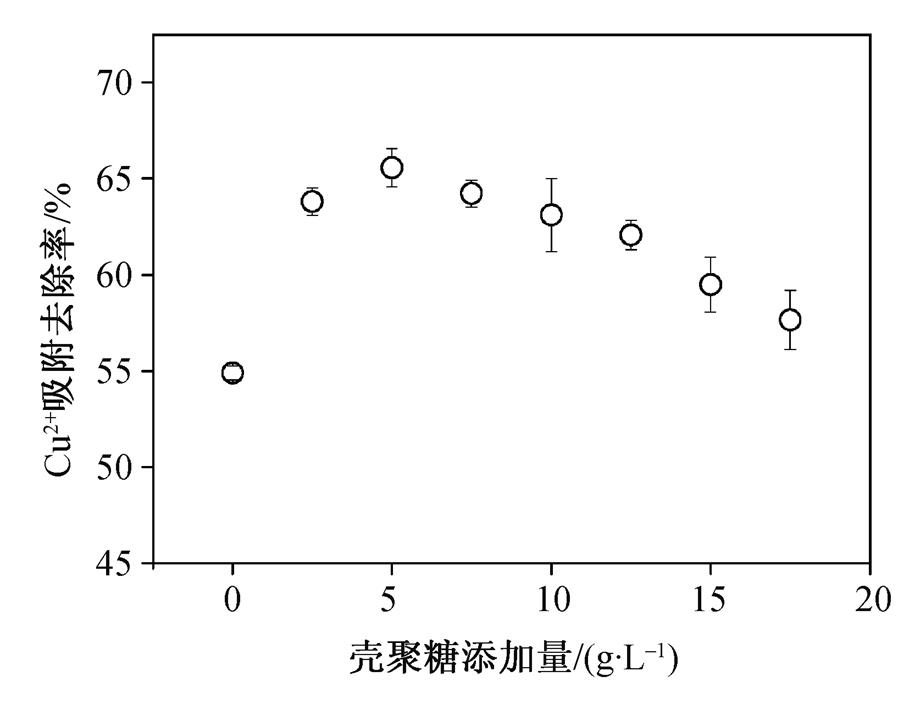
图3 壳聚糖添加量对MCSB吸附性能的影响
Fig. 3 Effect of CTS addition on adsorption capacity of MCSB
磁流体添加量对MCSB的吸附性能会产生不同程度的影响。同时, 磁流体添加量也会对MCSB的磁性能产生影响。一般来说, 磁流体的添加量越大, MCSB的磁化强度越强, 只有达到一定的磁化强度才能使MCSB迅速从水体中分离。从图 4 可以看出, 对于25mg/L的Cu 2+ 溶液, 随着磁流体添加量的不断增加, MCSB对水中Cu 2+ 的吸附去除率呈不断下降的趋势, 即磁流体的添加不利于提升MCSB的吸附性能。与未添加磁流体的凝胶球相比, 当Fe 3 O 4 磁流体添加量为1.16g/L后, MCSB对水中Cu 2+ 的吸附去除率从73.92%下降至68.13%。上述结果表明, 在保证MCSB具有所需的磁化强度后, 选择较小的磁流体添加量更为有利。结合磁分离实验发现, 当磁流体添加量为4.64g/L时, MCSB才开始具有较好的磁分离效果。因此, 选取最优的磁流体添加量为4.64 g/L。
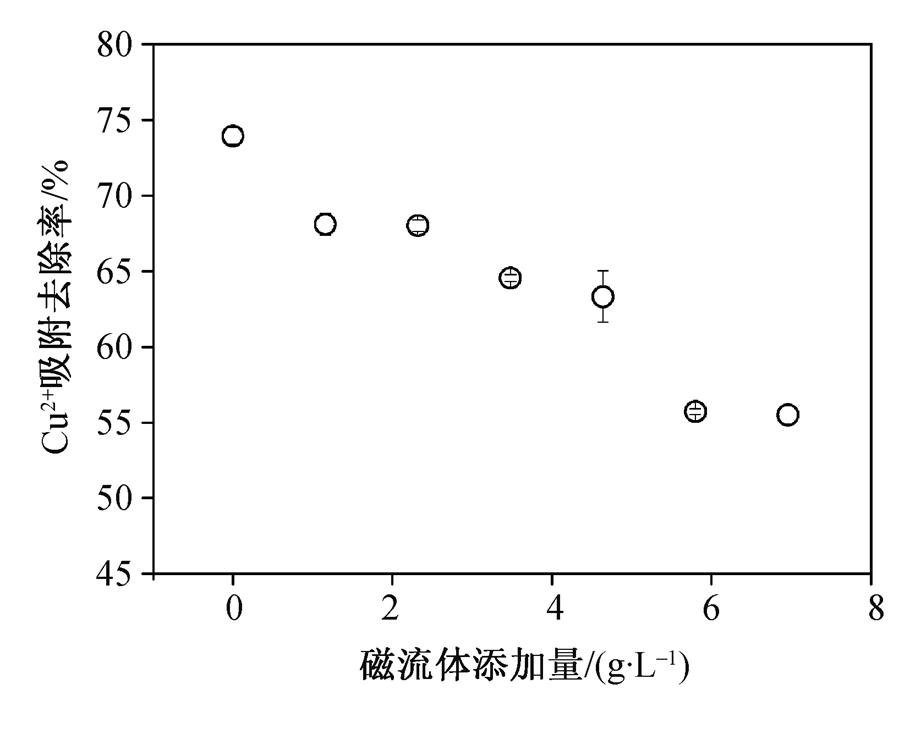
图4 磁流体添加量对MCSB吸附性能的影响
Fig. 4 Effect of Fe 3 O 4 addition on adsorption capacity of MCSB
图5是不同壳聚糖、磁流体添加量条件下制备的复合凝胶球的热失重曲线。从图5(a)可以看出, 随着温度的上升, 凝胶球的质量主要经历两段下降过程。在0~200ºC开始加热时, 下降速率较缓慢, 质量下降16.79%, 主要是自由水和结合水的蒸发所致; 在200~300ºC之间, 样品经历了一个快速分解阶段, 质量下降23.21%; 在400ºC之后, 热失重曲线进入较平稳的水平阶段。在600ºC时, 5CTS-MCSB, 10CTS-MCSB和15CTS-MCSB凝胶球最终的剩余质量比例分别为48.56%, 45.61%和41.30%,各样品的剩余重量排序为5CTS-MCSB>10CTS-MCSB>15CTS-MCSB, 表明随着壳聚糖添加量的增加, 样品凝胶球的剩余质量越低。这是由于在制备过程中, 增加壳聚糖的添加量意味着在同等凝胶球质量中壳聚糖的比例有所提高, 当温度达到300ºC时, 壳聚糖分子主链开始分解, 因此, 在同等质量下, 相对壳聚糖含量较高的凝胶球最终在600ºC时分解后的剩余质量更低。
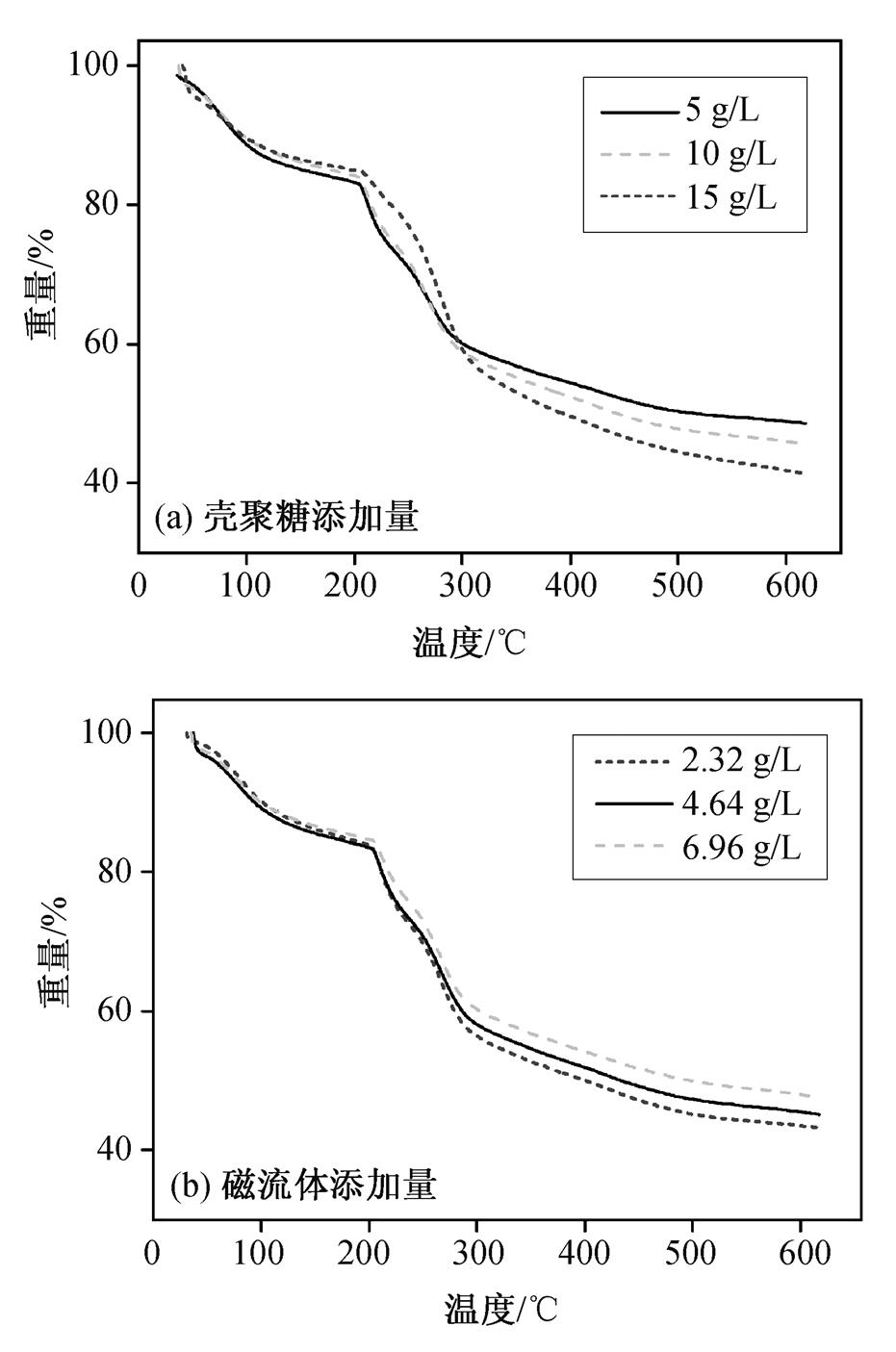
图5 不同组成的MCSB的热失重曲线
Fig. 5 Thermal gravity curves of different CTS addition and different Fe 3 O 4 addition
从图5(b)看出, 2.32Fe-MCSB, 4.64Fe-MCSB和6.96Fe-MCSB的热失重曲线与图5(a)的趋势基本上一致。在制备过程中, 由于磁流体添加量的增加, 同等质量凝胶球样品中的其他易分解成分相对更少, 而Fe 3 O 4 的分解温度可达上千摄氏度, 超过600ºC的测量温度上限。600ºC时, 2.32Fe-MCSB, 4.64Fe-MCSB和6.96Fe-MCSB凝胶球的最终剩余质量比例分别为43.24%, 45.12%和47.57%, 各样品的剩余重量排序为6.96Fe-MCSB>4.64Fe-MCSB>2.32Fe-MCSB, 表明随着磁流体添加量的增加, 样品凝胶球的剩余质量也越大。
总的来说, MCSB的热稳定性良好, 能够应用于一般重金属废水的处理, 实验条件范围内不同的磁流体和壳聚糖添加量对MCSB的热稳定性影响不大。同时, 壳聚糖和磁流体添加量每增加一个梯度, 凝胶球的最终剩余质量也相应地减少和增加一个梯度, 表明添加的壳聚糖和磁流体能够均匀地分布在复合凝胶球中。
图 6 是MCSB, MSB和CSB凝胶球的红外光谱图。可以看出, 3种凝胶球的 FTIR 谱走向大体上保持一致, 通过参考文献[20–21]及比对分析可以看出, 在MCSB和MSB的FTIR谱中, 3560cm –1 处伸缩振动对应的是羟基―OH的特征吸收峰, 这一位置在CSB的FTIR谱中则略微移动到3590cm –1 处, 发生位移的原因可能是由于Fe 3 O 4 的加入。3310cm –1 处是N―H的伸缩振动吸收峰, 与MSB相比, MCSB和CSB的FTIR谱中的N―H伸缩振动吸收峰移动到3280cm –1 处, 这是由于壳聚糖的引入增加了凝胶球中氨基的含量。另外, MCSB和CSB的FTIR谱中分别新出现的879cm –1 和866cm –1 两处吸收峰可能是壳聚糖中C—O的伸缩振动吸收峰。1660cm –1 和1440cm –1 处分别是仲酰胺羰基C=O的伸缩振动吸收峰和 COO — 的对称伸缩振动吸收峰, 2930cm –1 处是烷烃―CH 2 的反对称伸缩振动吸收峰, 这3处特征吸收峰在3种凝胶球的FTIR谱中没有出现明显的位置变化, 磁流体和壳聚糖的加入没有对吸收峰的位置产生显著影响, 这 3 处对应的活性基团可能是由 3 种凝胶球共有的海藻酸钠组分贡献的 [20 − 21] 。总体上, 凝胶球表面的活性基团主要有羟基、氨基和羧基等, 这些基团可以与水中的Cu 2+ 发生络合反应或离子交换反应, 在吸附过程中发挥重要作用。
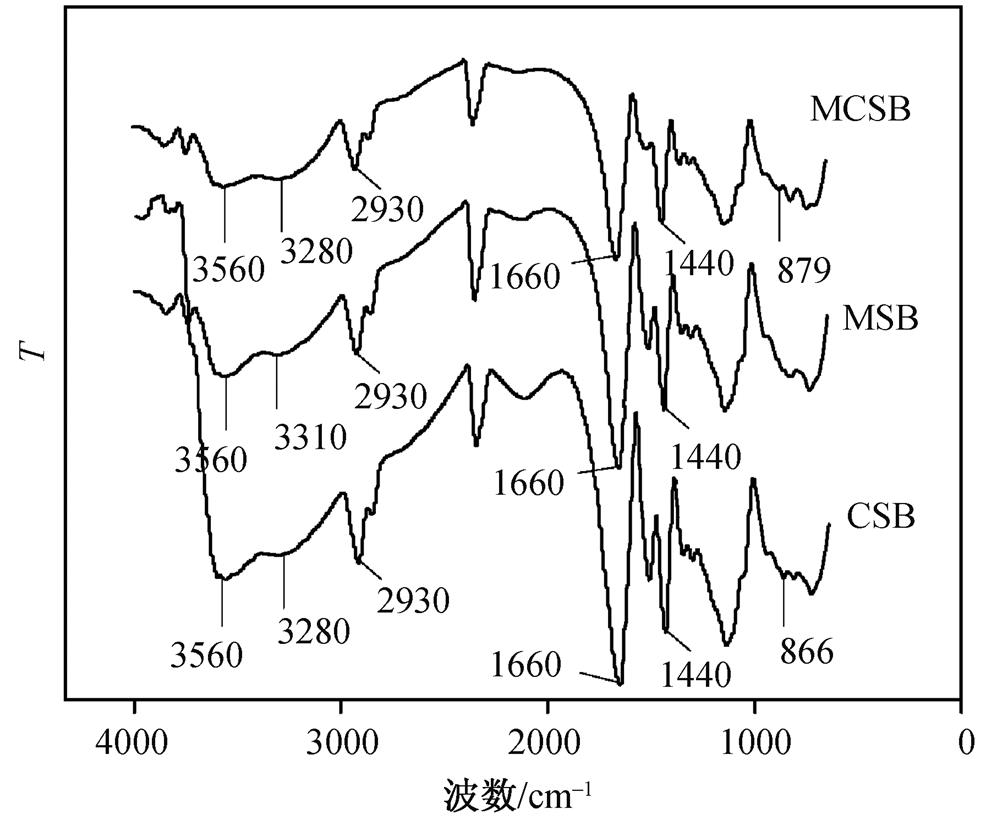
图6 MCSB、MSB和CSB凝胶球的红外光谱
Fig. 6 FTIR spectra of MCSB, MSB and CSB
图 7 是制得的MCSB的外观形貌及其在外加磁场条件下的磁分离效果。从图中可以直观地看到, 制备出的MCSB凝胶球表面光滑,大小均匀, 纯黑色, 呈球形, 直径在 2 mm左右, 同时具有一定的弹性和不错的机械强度。将MCSB凝胶球放置在水中, 在外加磁场的条件下, 会迅速地向磁铁处靠近聚集, 一旦撤去磁铁, 凝胶球又重新分散在水体中, 表明MCSB复合凝胶球具有较好的顺磁性。
2.8.1 吸附剂用量的影响
吸附剂用量对MCSB吸附Cu 2+ 效果的影响如图8 所示。可以看出, 随着MCSB吸附剂用量的不断增加, MCSB对水中Cu 2+ 的吸附去除率不断增加, 当MCSB 用量从 2.5 mg 增至 20 mg时, Cu 2+ 的吸附去除率从17.32%增至78.13%, 因此增加吸附剂用量有利于提升Cu 2+ 废水的处理效果。另一方面, 随着MCSB凝胶球吸附剂用量的增加, MCSB凝胶球对水中Cu 2+ 的吸附量呈先增加、后减小的趋势。当MCSB吸附剂用量为5mg时, MCSB凝胶球的吸附量达到最高值84.81mg/g, 此时的Cu 2+ 吸附去除率为38.39%。这是由于当MCSB用量较小时, 吸附去除率较低, 固液两相之间的传质推动力不足, 因此, 在MCSB用量达到一定的水平之前, MCSB的吸附量会增大。随着MCSB吸附剂用量的进一步增加, 为Cu 2+ 提供了更多的吸附位点, 但由于溶液Cu 2+ 浓度是一定的, 分配到MCSB吸附剂表面每单位吸附位点的Cu 2+ 量便有所降低, 因此MCSB的吸附量也开始下降。从总体上看, MCSB具有良好的吸附性能。
2.8.2 pH的影响
在实际工程应用中, 溶液的pH值会影响重金属离子与吸附剂表面吸附位点的结合。从图 9 可以看出, 随着pH值的增加, MCSB对水中Cu 2+ 的吸附量逐渐增加, 吸附去除率也逐渐增大, 表明pH值的增加有利于溶液中Cu 2+ 的吸附。当pH为1~2时, 溶液H + 浓度较高, H + 会与Cu 2+ 之间发生竞争, 抢先占据MCSB凝胶球表面羧基等活性基团的重金属吸附位点, 从而显著降低MCSB的吸附能力, 在实验中表现为吸附量和吸附去除率均较低。当pH值增加到3以上时, 溶液中H + 浓度不断降低, MCSB凝胶球表面的吸附位点又重新暴露出来, 与Cu 2+ 结合, 使MCSB的吸附能力不断提高。当pH增加到7后, 水中Cu 2+ 会形成沉淀。MCSB的溶液pH适用范围为3~6, 在此范围内, MCSB具有较强的吸附能力, 而常见的铜污染废水的pH值也大致在3~6之间, 因此MCSB能够满足实际应用的需要。此外, 在工程实践中, 可以应用低浓度的盐酸或EDTA溶液, 对MCSB凝胶球进行洗脱再生, 重复利用。

图7 MCSB的磁分离效果(a)和MCSB外观(b)
Fig. 7 Photograph of magnetic separation of MCSB (a) and appearance of MCSB (b)
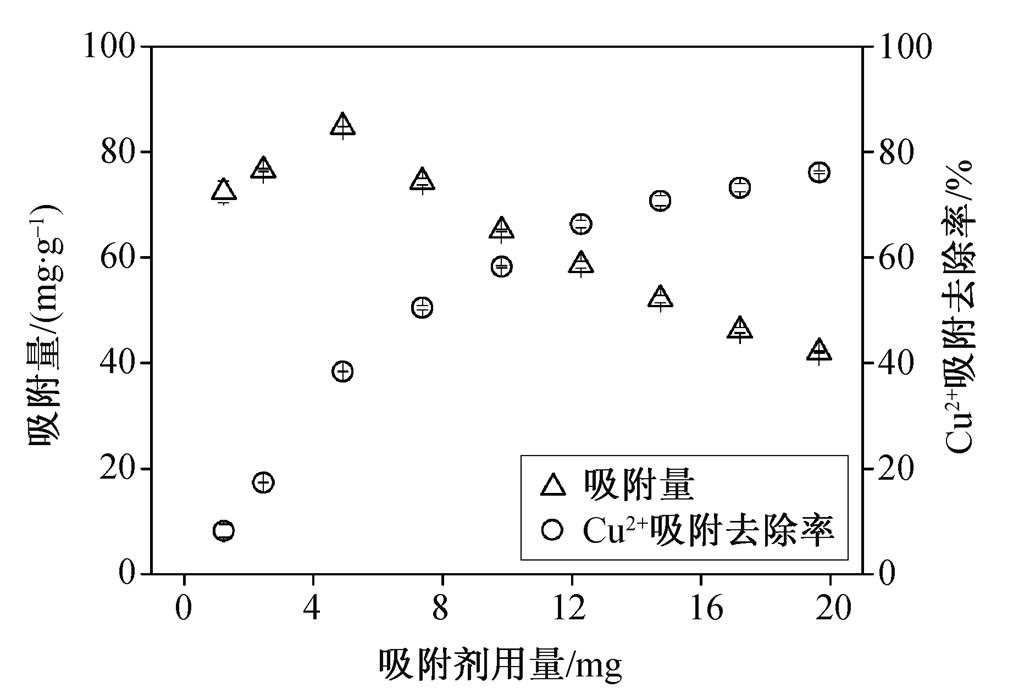
图8 吸附剂用量对吸附的影响
Fig. 8 Effect of adsorbent dosage on adsorption capacity of MCSB
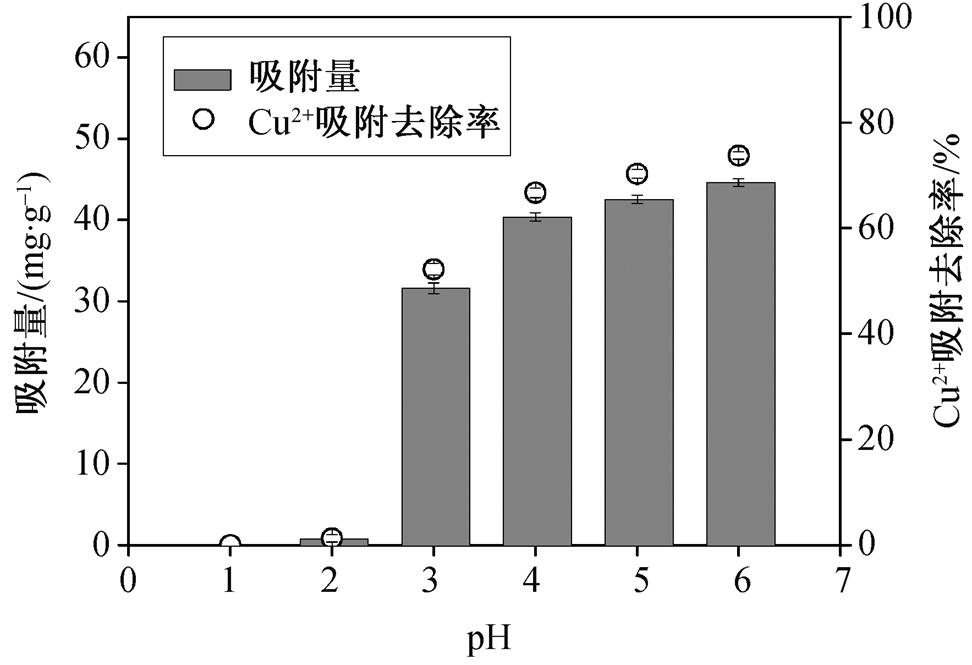
图9 pH对吸附的影响
Fig. 9 Effect of pH on adsorption capacity of MCSB
磁性壳聚糖/海藻酸钠凝胶球作为一种新型复合吸附剂, 制备过程简单, 吸附性能良好, 具有一定的应用潜力。本文实验的主要结论如下。
1)通过正交试验和单因素实验, 确定了凝胶球的最优制备条件: CaCl 2 浓度为2.5g/L, 海藻酸钠浓度为24g/L, 壳聚糖添加量为5g/L, 磁流体添加量为4.64g/L。制备出的凝胶球的表面光滑, 大小均匀, 纯黑色, 呈球形, 直径在2 mm左右, 具有顺磁性。
2)热分析结果表明, MCSB的热稳定性良好, 不同的磁流体和壳聚糖添加量对MCSB的热稳定性影响不大。
3)红外光谱分析结果表明, 凝胶球表面的活性基团主要有羟基、氨基和羧基等, 添加磁流体和壳聚糖对凝胶球表面活性基团的影响较小。
4)当MCSB用量为20 mg时, 对40 mL 25 mg/L Cu 2+ 溶液的吸附去除率为78.13%, MCSB的pH适用范围为3~6。
参考文献
[1]Fu F, Wang Q. Removal of heavy metal ions from wastewaters: a review. Journal of Environmental Management, 2011, 92(3): 407–418
[2]Kurniawan T A, Chan G Y S, Lo W, et al. Physico-chemical treatment techniques for wastewater laden with heavy metals. Chemical Engineering Journal, 2006, 118(1/2): 83–98
[3]Wan Ngah W S, Hanafiah M A K M. Removal of heavy metal ions from wastewater by chemically modified plant wastes as adsorbents: a review. Bio- resource Technology, 2008, 99(10): 3935–3948
[4]Rao G, Lu C, Su F. Sorption of divalent metal ions from aqueous solution by carbon nanotubes: a review. Separation and Purification Technology, 2007, 58(1): 224–231
[5]Babel S, Kurniawan T A. Low-cost adsorbents for heavy metals uptake from contaminated water: a review. J Hazard Mater, 2003, 97: 219–243
[6]Sud D, Mahajan G, Kaur M. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions ― a review. Bio-resource Technology, 2008, 99(14): 6017–6027
[7]李鲁中. 聚乙烯醇/壳聚糖/氧化石墨烯复合水凝胶的制备及对 Pb(Ⅱ)吸附性能研究. 化工新型材料, 2016, 44(4): 112–115
[8]Vijaya Y, Popuri S R, Boddu V M, et al. Modified chitosan and calcium alginate biopolymer sorbents for removal of nickel (П) through adsorption. Carbohy- drate Polymers, 2008, 72(2): 261–271
[9]Papageorgiou S K, Kouvelos E P, Katsaros F K. Calcium alginate beads from Laminaria digitata for the removal of Cu 2+ and Cd 2+ from dilute aqueous metal solutions. Desalination, 2008, 224: 293–306
[10]丁当仁, 魏巍, 周琪, 等. 氨基改性壳聚糖复合二氧化硅气凝胶的制备及其对 Cu(Ⅱ)、Cd(Ⅱ)、Pb(Ⅱ)离子的吸附性能研究. 硅酸盐通报, 2015, 34(7): 1953–1958
[11]Qu R, Sun C, Ma F, et al. Removal and recovery of Hg(Ⅱ) from aqueous solution using chitosan-coated cotton fibers. Journal of Hazardous Materials, 2009, 167: 717–727
[12]Pandey S, Tiwari S. Facile approach to synthesize chitosan based composite: characterization and cad-mium(Ⅱ) ion adsorption studies. Carbohydrate Poly-mers, 2015, 134(2): 646–656
[13]莫冰玉, 唐玉斌, 陈芳艳, 等. 磁性活性炭的制备及其对水中甲基橙的吸附. 环境工程学报, 2015, 33(4): 1863–1868
[14]Girginova P I, Daniel-Da-Silva A L, Lopes C B, et al. Silica coated magnetite particles for magnetic re-moval of Hg 2+ from water. Journal of Colloid and Interface Science, 2010, 345(2): 234–240
[15]Ge F, Li M, Ye H, et al. Effective removal of heavy metal ions Cd 2+ , Zn 2+ , Pb 2+ , Cu 2+ from aqueous solution by polymer-modified magnetic nanoparticles. Journal of Hazardous Materials, 2012, 211/212: 366–372
[16]Tang S C N, Lo I M C. Magnetic nanoparticles: Essential factors for sustainable environmental appli- cations. Water Research, 2013, 47(8): 2613–2632
[17]Xu P, Zeng G M, Huang D L, et al. Use of iron oxide nanomaterials in wastewater treatment: a review. Science of The Total Environment, 2012, 424(21): 1–10
[18]Fakhrullin R F, García-Alonso J, Paunov V N. A direct technique for preparation of magnetically func- tionalised living yeast cells. Soft Matter, 2010, 6(2): 391–397
[19]Li Y, Liu F, Xia B, et al. Removal of copper from aqueous solution by carbon nanotube/calcium alginate composites. Journal of Hazardous Materials, 2010, 177: 876–880
[20]Li Y, Xia B, Zhao Q, et al. Removal of copper ions from aqueous solution by calcium alginate immobi-lized kaolin. Journal of Environmental Sciences, 2011, 23(3): 404–411
[21]Boddu V M, Abburi K, Talbott J L, et al. Removal of arsenic(Ⅲ) and arsenic(V) from aqueous medium using chitosan-coated biosorbent. Water Research, 2008, 42(3): 633–642
Preparation and Optimization of a Novel Magnetic Chitosan/Sodium Alginate Composite Gel Bead
TAO Huchun † , LI Shuo, ZHANG Lijuan, LI Jinbo, YANG Sai
Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055
Abstract Using sodium alginate hydrogel as skeleton, in combination with chitosan and magnetic Fe 3 O 4 , a new type of magnetic chitosan/sodium alginate gel bead was prepared. On this basis, through the orthogonal experiment and single-factor experiment, the authors optimized the preparation conditions for composite gel bead, and determined the optimum one. The influences of many preparation impact factors on adsorption performance were examined. Results show that the optimal preparation conditions for the composite gel bead is as follows. Concentration of calcium chloride is 2.5 g/L, concentration of sodium alginate is 24 g/L, the amount of chitosan addition is 5 g/L, and the amount of magnetic liquid addition is 4.64 g/L. The optimal gel bead is a smooth, uniform, black ball with about 2 mm in diameter. By Fourier transform infrared spectroscopy (FTIR), synchronous thermal analysis (TGA) and other means of characterization, the adsorption mechanism is analyzed. Thermo-gravimetric analysis results show that the gel bead has good thermal stability. FTIR results prove that many active functional groups (amino group, hydroxyl group and carboxyl group) exist on the surface of gel bead. The adsorption performance test shows that adsorption ratio of 20mg MCSB on 40mL 25mg/L Cu 2+ solution is 78.13%. The magnetic chitosan/sodium alginate gel bead is a novel simple-prepared and effective composite adsorbent.
Key words sodium alginate gel bead; chitosan; magnetic Fe 3 O 4 ; Cu 2+
doi: 10.13209/j.0479-8023.2017.186
中图分类号 X703
收稿日期: 2017-04-17;
修回日期: 2017-05-05;
网络出版日期: 2018-01-17
深圳市科技计划项目(JCYJ20150731091351923)和流域生态工程学学科建设资金(深发改[2017]542 号)资助
† E-mail: taohc@pkusz.edu.cn
† E-mail: taohc@pkusz.edu.cn