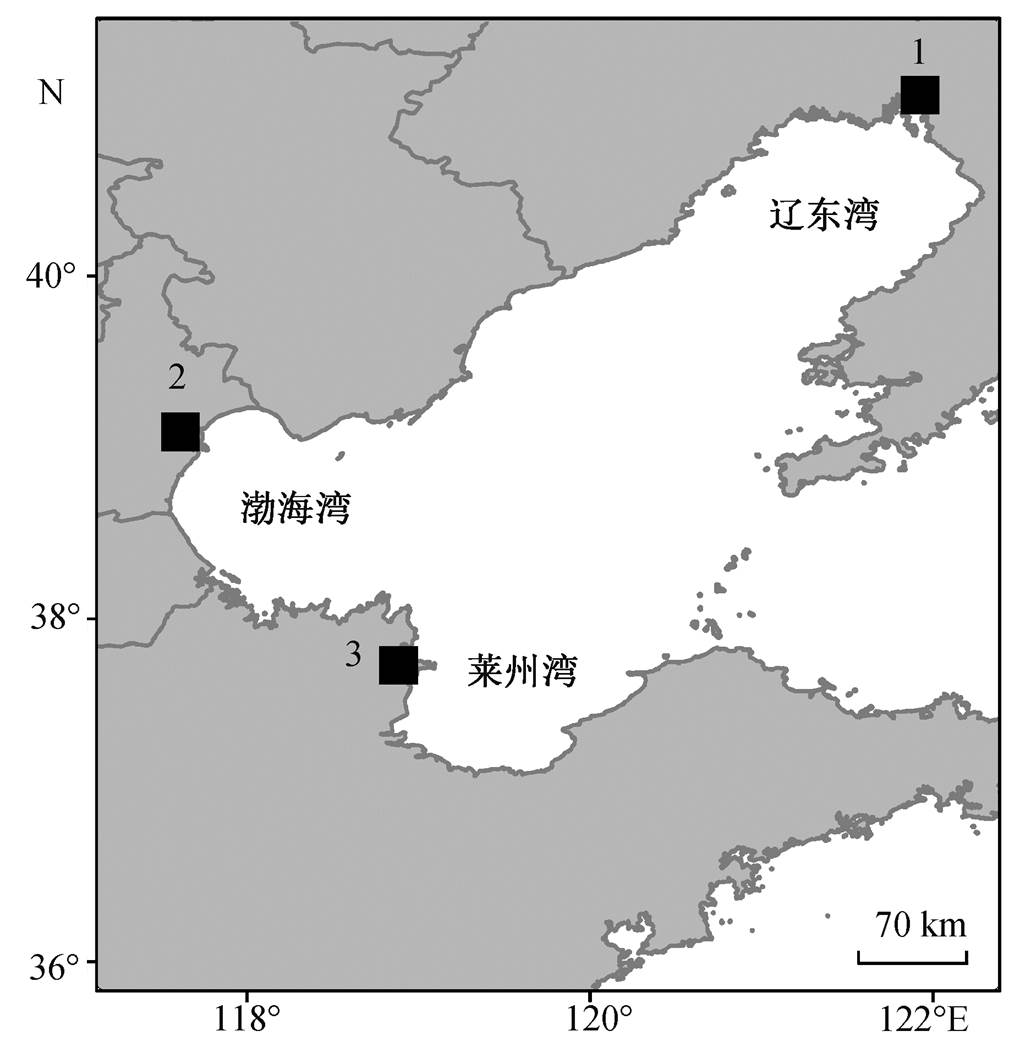
1. 辽河口芦苇湿地; 2. 天津北大港滩涂湿地; 3. 黄河河口湿地
图1 环渤海湿地沉积物采样点分布
Fig. 1 Distribution of the sampling sites in Bohai Rim
黄斯乔 籍国东 †
水沙科学教育部重点实验室, 北京大学环境科学与工程学院, 北京 100871
摘要 为了揭示不同温度下环渤海典型湿地沉积物中二苯并噻吩(DBTs)的降解途径, 选择辽河口芦苇湿地、天津北大港滩涂湿地和黄河河口湿地的 3 种不同湿地沉积物, 在模拟季节性温度条件下, 培养 56 天, 测定DBT 的降解率, 分析 DBT 降解功能基因的丰度, 建立 DBT 降解率与功能基因群组定量响应关系模型, 解析不同温度下3种湿地沉积物中DBT的降解途径。实验结果表明, 3种湿地沉积物中DBT的降解率均随培养温度升高而升高, 4ºC 培养时, DBT 的降解率排序为黄河河口湿地>天津北大港滩涂湿地>辽河口芦苇湿地; 30ºC培养时, DBT的降解率排序为北大港滩涂湿地>黄河河口湿地>辽河口芦苇湿地; catA 与 dszB 基因影响DBT 的降解速率。低温条件和中温条件下, 在 3 种湿地中, 代表 Kodama 途径的 nagAc/nahAc 和 nidA 基因分别起主要作用, 代表4S途径的 dszB 基因在黄河河口湿地及北大港滩涂湿地中有重要作用。
关键词 二苯并噻吩; 湿地沉积物; 环渤海; 功能基因; 降解途径
环渤海湿地具有养分循环、调节环境、保持生物多样性等诸多生态服务功能 [1] 。然而, 随着人类活动的加剧, 以中国石油天然气集团公司大连海域污染事件和渤海湾康菲公司溢油事件为代表的石油污染事件频发, 导致环渤海湿地环境不断恶化。对溢油事故污染的湿地沉积物, 通常采用物理化学方法进行紧急处理, 但难以有效地去除高硫原油中二苯并噻吩(DBTs)等硫杂环芳香烃类有机物。因具有选择性和经济性等优点, 微生物降解二苯并噻吩化合物的方法在相关领域的研究相当活跃 [2–3] , 微生物降解DBTs主要有Kodama途径和4S途径 [4–5] 。
Kodama途径是通过酶选择性地将DBT分子中的C—C键断裂, 而将C—S键保留下来, 生成溶于水的小分子有机硫化物, 硫仍然保留在产物中, 因此被认为是DBT的代谢途径。Kodama途径的降解过程与低环芳烃类似, 首先由羟基化双加氧酶对苯环进行氧化, 在起始双加氧酶作用下, 形成顺式二氢二醇产物。参与该催化反应的双加氧酶是一个多组分的复杂酶系, 由三部分组成: 一个铁氧化还原蛋白还原酶、一个铁氧化还原蛋白和一个铁硫蛋白(ISP)。ISP由两个不等同的 α 和 β 亚基构成, 其中 α 亚基包括两个相对保守的区域。通常情况下, 芳烃降解过程中的环氧化反应都是关键限速步骤, 因此研究者多通过测定环境中编码 α 亚基基因的含量来反映微生物降解的潜力 [6] 。常被测定的基因通常包括萘羟基化双加氧酶系列( nahAc )、萘羟基化双加氧酶大亚基系列( nagAc ) [7] 和芘羟基化双加氧酶基因( nidA ), 其中 nidA 既可以降解菲、萘等低环芳烃, 同时, 也可以降解芘以及苯并芘等高环芳烃 [8] , 在Kodama途径的上游氧化开环过程中亦起到重要作用。DBT经过起始双加氧酶的氧化, 再经由开环、异构化、脱氢等反应, 降解生成水杨酸, 从而进入DBT的下游代谢过程。在水杨酸羟化酶的作用下, 水杨酸生成邻苯二酚。邻苯二酚是下游代谢过程中的一个重要中间产物, 在邻苯二酚1,2-双加氧酶基因( catA )作用下, 开环裂解生成三羧酸循环中间物, 最后被彻底氧化成CO 2 和水 [9] 。
4S脱硫途径是在脱硫酶的作用下, 选择性地切断DBT的C—S键, 使DBT降解形成的2-羟基联苯而保留在产物中, S原子被氧化成溶于水的SO 3 2 − 而被分离出来, 因此4S脱硫途径被认为是DBT的脱硫途径 [10–11] 。4S途径中, 二苯并噻吩先通过DBT单加氧酶( dszC) 和DBT砜单加氧酶( dszA )的作用, 氧化形成苯基磺酸盐(HPBS), 再在起关键性作用的、切断C—S键的磺酸盐脱硫酶( dszB )作用下进行脱硫, 在此期间, 黄素还原酶( dszD )共同参与整个过程。由于4S途径的关键性步骤是最后的脱硫, 因此 dszB 基因可视为4S途径降解二苯并噻吩的标志性基因 [12] 。
对于被高硫石油污染的河口海岸湿地, 季节性的温度变化是影响其沉积物中芳香烃微生物降解途径的重要因素 [13] , 但目前对于不同温度下环渤海典型湿地沉积物中Kodama途径和4S途径在DBT降解过程中的贡献程度及相互关系的研究较少。为了揭示不同温度下环渤海典型湿地沉积物中二苯并噻吩(DBT)的降解途径, 本文选择辽河口芦苇湿地、天津的北大港滩涂湿地和黄河河口湿地的3种不同湿地沉积物, 在模拟四季温度条件下培养56天, 测定DBT的降解效率, 分析DBT降解功能基因的丰度, 建立DBT降解效率与功能基因群组定量响应关系模型, 解析不同温度下不同湿地沉积物中DBT的降解途径。
用于实验的沉积物样品取自环渤海湾沿海湿地, 分别是位于辽宁的盘锦辽河口芦苇湿地、天津的北大港滩涂湿地以及山东的东营黄河河口湿地(图1), 其临近海域分别为辽东湾、渤海湾及莱州湾。在取样点附近选择3~5个子样点, 每个子样点间距不小于1 km, 采集湿地沉积物表层约10~30 cm的样品。在每个子样点采集1 kg左右沉积物并充分混合, 装入可密封的聚乙烯塑料袋中, 用低于4ºC的冷藏箱密封保存。

1. 辽河口芦苇湿地; 2. 天津北大港滩涂湿地; 3. 黄河河口湿地
图1 环渤海湿地沉积物采样点分布
Fig. 1 Distribution of the sampling sites in Bohai Rim
为了模拟自然环境中沉积物降解DBT的环境条件, 在250mL锥形瓶中装入100g经过自然风干并研磨至80目的沉积物, 配制二苯并噻吩/二氯甲烷溶液, 加入锥形瓶中搅拌均匀, 使沉积物中二苯并噻吩的浓度达到10mg/kg, 以此模拟受污染沉积物, 然后置于通风橱中挥发过夜, 最后加入适量蒸馏水保持含水量。放入恒定温度培养箱(4ºC, 10ºC, 20ºC和30ºC)中进行培养, 模拟季节性温度变化(冷季12—3月, 对应的温度为4ºC; 暖季7—8月, 对应的温度为30ºC; 过渡季节4—6月和9—11月, 对应的温度分别为10ºC和20ºC), 并分别在0, 4, 7, 10, 14, 20, 28, 36, 45和56天取样测定。每两天进行搅拌, 并添加去离子水, 使沉积物的湿度保持稳定。
对土壤中二苯并噻吩的提取采用震荡−超声法 [14] , 对土壤中残余二苯并噻吩浓度的测定采用安捷伦7890GC/5973MS色谱−质谱联用仪。色谱条件: DB-5MS石英毛细管色谱柱(30m×0.25mm×0.25 μm), 色谱进样口及GC/MS接口温度均为250ºC。升温程序: 150ºC保持2分钟, 以15ºC/min升至250ºC, 保持10分钟。质谱条件: EI电离源, 电子能量为70 eV, 离子源温度为250ºC, 扫描范围为30~500 amu [15] 。
沉积物DNA的提取采用OMEGA沉积物基因组提取试剂盒法。功能基因的丰度值采用FTC-300荧光定量PCR仪测定, 采用 25μL扩增体系: 10×buffer (含Mg 2+ ) 2.5μL, 2.5mmol/L的dNTP2μL, 样品的DNA溶液1μL, 2.5U/μL的Taq 酶 0.25μL, 正反向引物10μmol/L, 加入无菌的双蒸水水(ddH 2 O)到总体积25μL。正反引物片段如表 1 所示, 反应程序见文献[16–19], 基因作用点见图 2。
通径分析用来确定DBT的降解途径及各功能基因的降解贡献。运用SPSS软件, 采用多元逐步线性回归法, 拟合通径模型并确定直接影响系数和间接影响系数。直接影响系数体现该功能基因对降解的直接贡献程度, 间接影响系数则体现不同基因之间的互相作用。间接系数为正, 表明两者相互促进, 间接系数为负, 表示两者相互抑制。以DBT降解量为因变量, 以 nahAc , nagAc , nidA , catA 和 dszB 功能基因的绝对丰度及相对丰度为自变量, 运用SPSS软件进行统计分析并建立逐步回归方程, 计算影响系数, 最终得出响应关系及贡献程度。
实验结果表明, 温度对DBT的降解率影响较大, 4ºC培养时, DBT降解率的排序为黄河河口湿地(21.8%)>北大港滩涂湿地(19.7%)>辽河口芦苇湿地(17.5%)。30ºC 培养时, DBT降解率的排序为北大港滩涂湿地(64.6%)>黄河河口湿地(55.3%)>辽河口芦苇湿地(54.5%)。在4~30ºC之间, 随着温度升高, 降解率明显提高(图3), 说明高温条件有助于湿地沉积物中二苯并噻吩的降解。原因是高温有助于降解菌的生长繁殖及降解酶活性的表达 [20] , 即自然环境下二苯并噻吩生物降解效果受温度影响较大, 在暖季(30ºC)达到其最优降解温度。研究表明, 温度升高会增加多环芳烃的水溶性, 提高其生物可利用性, 减少菌群对多环芳烃降解所需的驯化时间, 提高降解率和降解量 [21] 。
表1 16S rRNA, nahAc , nagAc , nidA , catA 和 dszB PCR引物
Table 1 PCR primers for the detection of 16S rRNA, nahAc , nagAc , nidA , catA and dszB genes

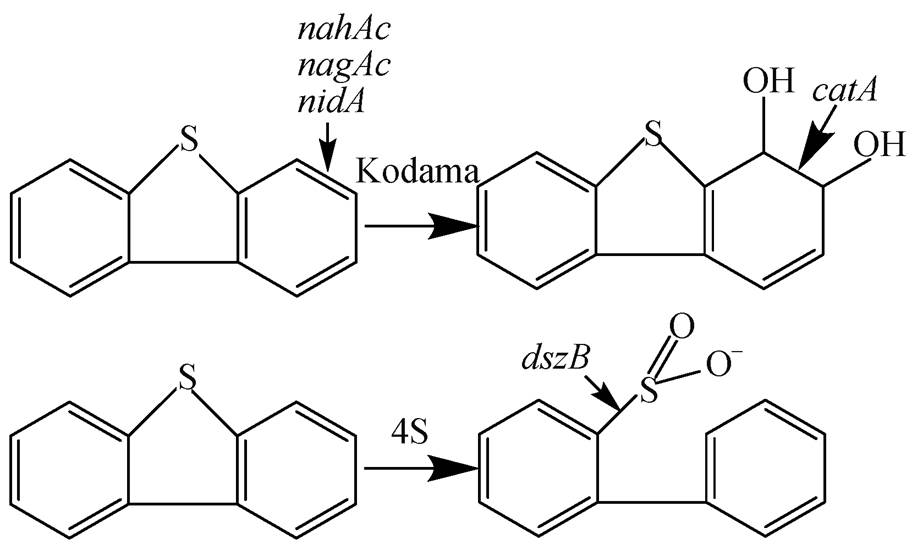
图2 二苯并噻吩降解Kodama途径及4S途径标志基因
Fig. 2 Degradation functional genes of DBT by Kodama pathway and 4S pathway
通过对降解率曲线(图4)的分析可知, 在10~20天时, 不同湿地沉积物中DBT降解的速率较快, 随着培养天数的增加, 高温条件下湿地沉积物仍然保持较高的降解速率, 但低温条件下降解速率曲线趋于平缓。在14天时, 不同湿地沉积物的DBT的降解速率均高于56天时, 这可能是由于在降解初期, 降解菌有充分的养分和DBT底物, 而随着时间的增加, 养分和底物的消耗导致降解受到一定程度的抑制。中温条件下DBT的降解速率明显高于低温条件下, 说明中温条件能够提高DBT的降解速率。
研究表明, 在微生物降解沉积物中二苯并噻吩的过程中, 功能基因的丰度与降解率的变化有紧密的联系, 并且在降解过程中, 携带不同功能基因的菌群存在共代谢及竞争关系 [22–23] 。因此, 通过对其丰度的分析, 能够得出不同温度条件下不同地点降解过程的趋同和趋异。本文选取第 14 天(降解速率较快的天数)及第 56 天(实验终点天数)作为时间点,对沉积物中总细菌基因含量及功能基因含量进行测定, 结果如图5所示。
不同地点湿地沉积物中 16S rRNA 丰度排序为辽河口芦苇湿地(4~30ºC:3.37×10 7 ~2.75×10 9 copies/g) >北大港滩涂湿地(4~30ºC: 7.71×10 6 ~2.29×10 9 copies/g)>黄河河口湿地(4~30ºC: 2.55×10 6 ~2.26×10 8 copies/g)。随着温度升高, 细菌16SrRNA基因丰度均有不同程度的升高, 说明温度对细菌总量的影响十分显著。 nahAc 基因丰度在第56天明显低于第14天, 说明14~56天时, 携带该功能基因的DBT降解菌群的生长繁殖受到抑制。第14天时, nagAc 基因丰度对温度变化的响应不显著, 第56天时, 对温度变化的响应则较为显著。第56天时, nidA 基因的绝对丰度明显高于第14天时, 说明在降解后期, 携带该基因的菌群在沉积物菌群的竞争中处于优势地位。 catA 基因的变化规律与16SrRNA类似, 在三类湿地沉积物中其丰度均随温度升高而显著升高。在黄河河口湿地中, 第56天时 catA 基因的丰度明显高于14天时, 而在辽河口芦苇湿地沉积物及北大港滩涂湿地沉积物中趋势正好相反。第14天时, 黄河河口湿地沉积物中代表4S途径的 dszB 基因丰度(1.61× 10 3 ~1.07×10 4 copies/g)高于辽河口芦苇湿地沉积物(4.91×10 1 ~1.85×10 2 copies/g)及北大港滩涂湿地沉积物(1.31×10 2 ~6.44×10 2 copies/g), 而代表Kodama途径的标志基因 nahAc , nagAc , nidA 和 catA 的丰度明显低于其他两种湿地沉积物。这说明在黄河河口湿地沉积物中, DBT的降解途径很有可能不同于其他两类湿地沉积物。为了进一步揭示DBT降解与功能基因的关系, 本文建立降解功能基因与降解量及降解速率的通径模型。
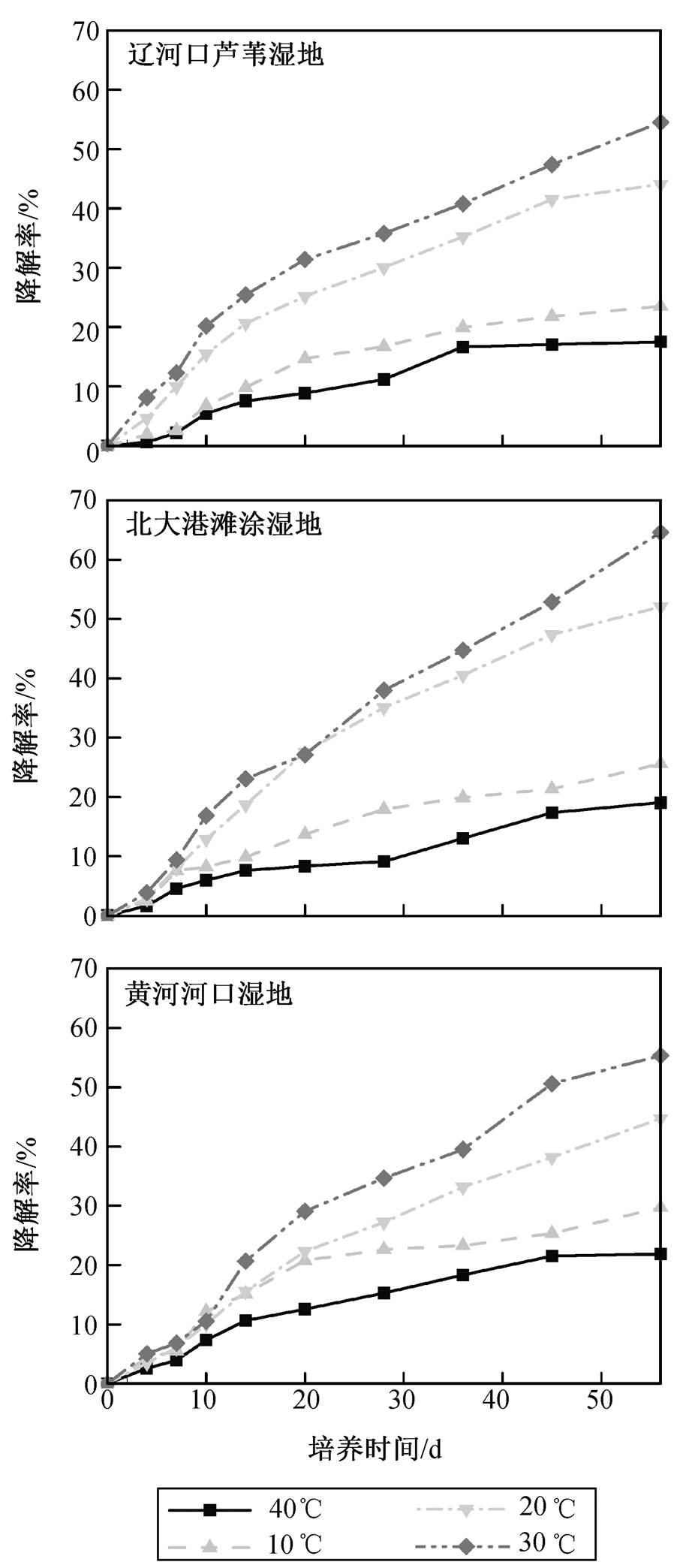
图3 环渤海湾湿地沉积物中二苯并噻吩的降解率曲线
Fig. 3 DBT degradation rate cruve of natural wetland sediments in Bohai Rim
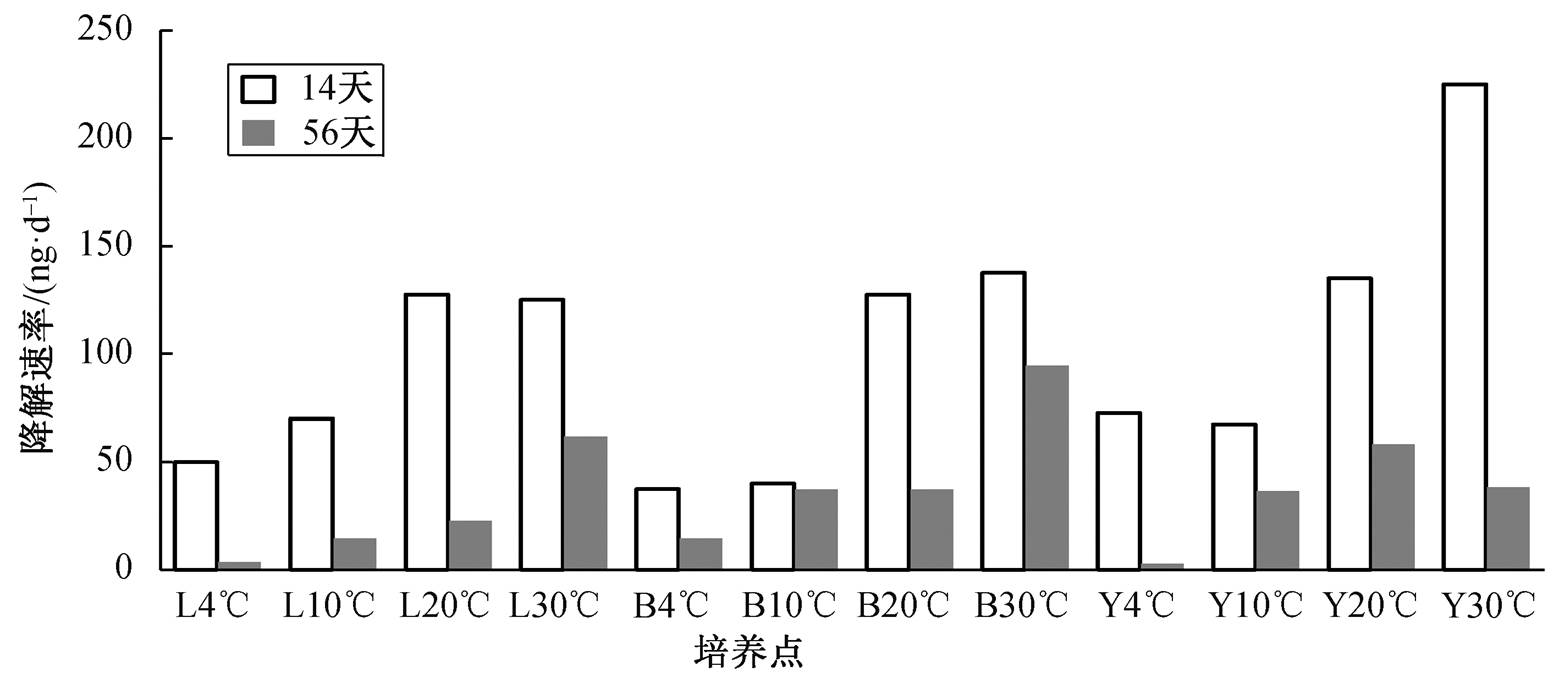
L: 辽河口芦苇湿地; B: 北大港滩涂湿地; Y: 黄河河口湿地
图4 不同温度下环渤海湿地沉积物中二苯并噻吩降解速率
Fig. 4 DBT degradation speed rate of wetland sediments in Bohai Rim at different temperatures
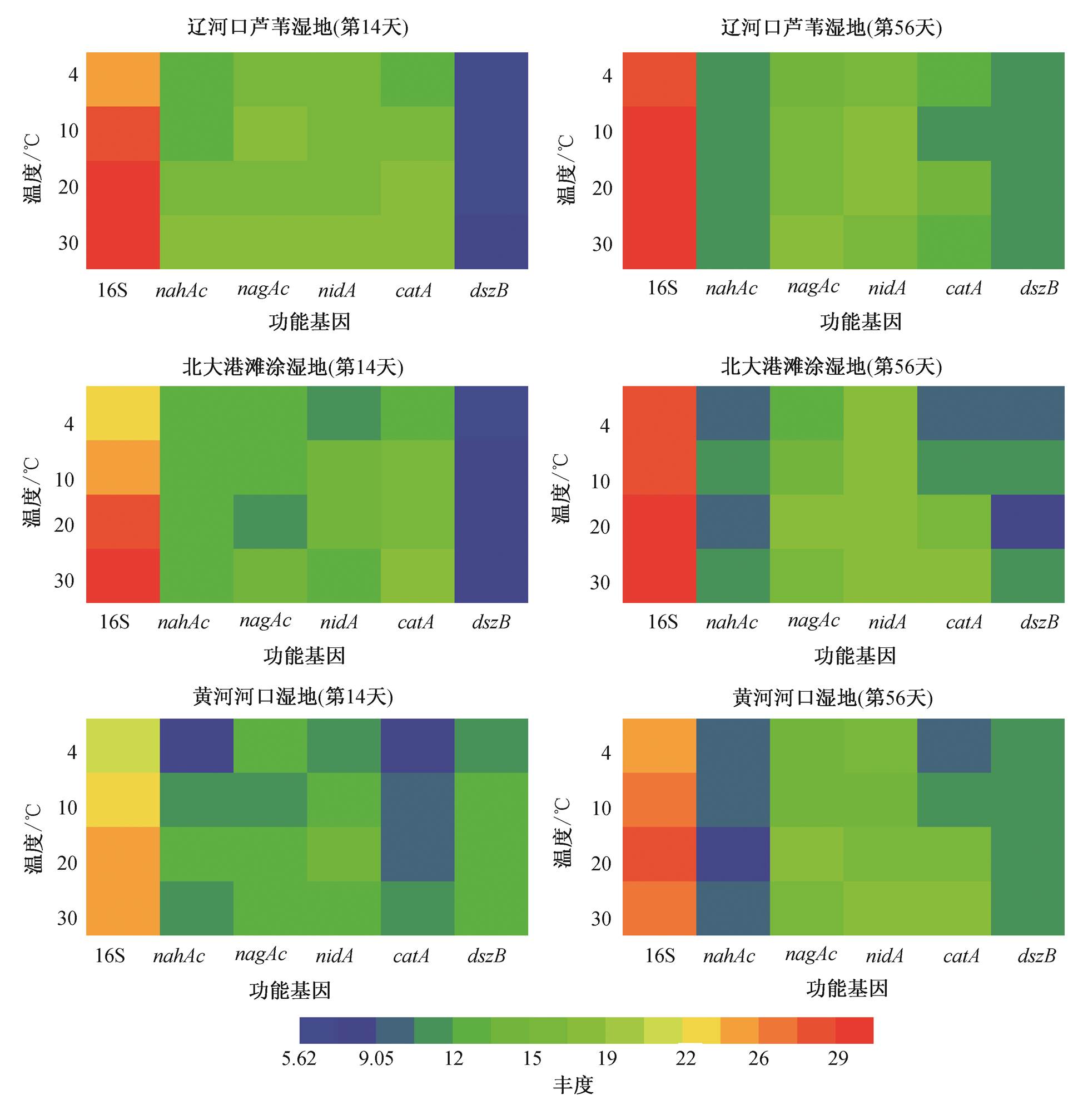
图5 沉积物功能基因绝对丰度热图
Fig. 5 Heatmap of functional genes abundance in sediments
以DBT降解速率为因变量, 以 nahAc , nagAc , nidA , catA 和 dszB 功能基因的绝对丰度及相对丰度为自变量, 运用SPSS软件进行统计分析, 并建立逐步回归方程, 计算影响系数, 结果如表 2和图6所示。由通径模型可知, catA 基因对DBT降解速率的影响系数为0.430。 catA 是DBT降解过程产物邻苯二酚降解的标志基因之一, 既属于Kodama途径下游降解的关键基因, 又可以对4S途径的最终产物进行降解 [24] , 因此 catA 基因在Kodama途径和4S途径中均起重要作用。由此可以确定, catA 基因是控制DBT降解速率的关键性基因, 在低温下, catA 基因的丰度明显低于高温下, 是3种湿地沉积物在低温条件下降解速率低于中温条件下降解速率的原因。 dszB 基因对DBT的降解起关键性的脱硫作用, 所以对DBT降解速率的影响也十分重要, 影响系数为0.494。在56天时, 辽河口芦苇湿地沉积物和北大港滩涂湿地沉积物中 catA 基因丰度均有所下降, 而 dszB 基因丰度却均上升, 可能是其DBT降解速率在14~56天保持稳定的原因, 尽管 dszB 基因的绝对丰度不是很高, 但对降解速率的贡献却十分突出。
表2 DBT降解速率逐步回归方程
Table 2 Stepwise regression equations of DBT degradation rate

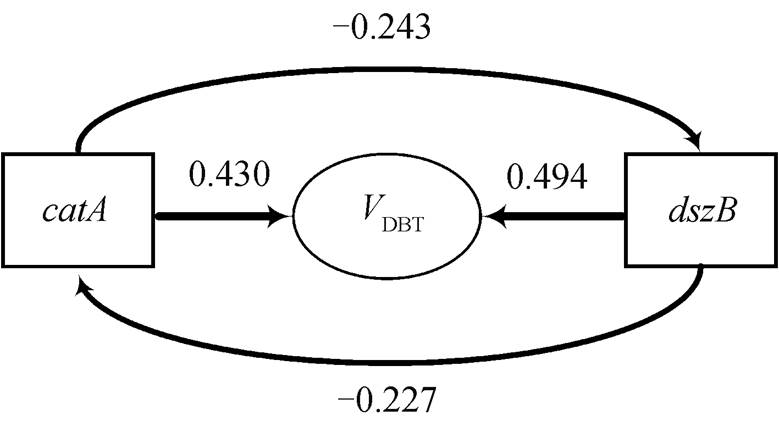
图6 环渤海湾典型湿地二苯并噻吩降解速率通径模型
Fig. 6 Degradation speed pathway of DBT degradation in Bohai Rim wetland
为了更好地分析DBT降解过程中降解量与功能基因的响应关系, 探讨其降解途径以及起主要作用的功能基因, 本文构建DBT降解量与相关功能基因之间的Pearson相关系数矩阵。由得出的相关系数可知, 在辽河口芦苇湿地沉积物中, DBT的降解量并不与某一种特定的基因相关。这表明在其沉积物系统中, 二苯并噻吩的降解受到多种基因以及环境的共同影响, 没有单独的功能基因对降解起主要作用。 nahAc 基因与 catA 基因有较好的相关性(相关系数为0.786), 这是由于在多环芳烃的降解过程中, 首先由降解上游的起始双加氧酶 nahAc 进行开环, 生成羟基类杂环化合物, 然后在降解下游途径的 catA 作用下进一步降解, 两者存在共同促进的关系 [25] 。在北大港滩涂湿地及黄河河口湿地中, DBT的降解量与 nidA 基因存在显著的相关性(相关系数为0.864)。 nidA 基因广泛地参与降解芘、苯并噻吩及二苯并噻吩过程 [25] , 其既能降解高环芳烃又能降解低环芳烃的特性使得携带此基因的菌种对多环芳烃污染的适应性较强。对北大港滩涂湿地底泥中降解菲、芴、蒽、芘、荧蒽和苯并芘混合液的实验中发现, 携带 nidA 基因的革兰氏阳性降解菌广泛存在, 而携带 nahAc 基因的假单胞菌存在量较少 [26] , 与本文实验结果类似。在北大港滩涂湿地沉积物及黄河河口湿地沉积物中, 代表4S降解途径的 dszB 基因与代表Kodama降解途径的 nahAc 和 nidA 基因显著相 关(相关系数分别为0.891和0.924), 说明4S途径与Kodama途径存在一定的生态联结性。
以DBT降解速率为因变量, 以 nahAc , nagAc , nidA , catA 和 dszB 功能基因的绝对丰度及相对丰度为自变量, 运用SPSS软件进行统计分析, 建立逐步回归方程, 并计算影响系数, 结果如表3和图7所示。不同湿地沉积物中降解二苯并噻吩的功能基因贡献和通径不尽相同。辽河口芦苇湿地沉积物中DBT降解以Kodama途径为主, 其上游基因 nagAc / nahAc 起关键作用。 nagAc 和 nahAc 同属起始双加氧酶系列基因, 都作用于Kodama降解途径的上游, 负责对DBT进行初步开环的氧化, 因此对DBT的降解量贡献较大。北大港滩涂湿地沉积物中 nidA 基因对DBT降解的影响系数达0.864, 说明Kodama途径仍然占主导地位, 但起关键性作用的是 nidA 基因, ( nagAc+nahAc )/ dszB 的影响系数为0.254, 说明4S途径也起一定的作用。在北大港滩涂湿地沉积物和黄河河口湿地沉积物中均存在部分4S途径的降解, 且两种途径之间存在一定程度的竞争关系, 这一点在黄河河口湿地中体现得尤为明显, Kodama降解功能基因的加和与4S途径降解功能基因 dszB 之比的影响系数高达0.938, 说明在黄河河口湿地沉积物中Kodama降解途径和4S降解途径都起重要的作用, 且两者互相影响。4S途径降解的上游需要氧气对C—S键进行氧化, 与Kodama途径上游的起始双加氧酶有争夺氧气的竞争作用 [27] 。并且其脱硫后的产物为2-羟基联苯, 在之后的降解过程中, 需要Kodama降解途径下游的相关基因进行开环代谢 [28] , 因此4S途径和Kodama途径互相均有一定程度的抑制作用。
表3 不同湿地沉积物DBT降解逐步回归方程
Table 3 Stepwise regression equations of DBT degradation in different types of wetland

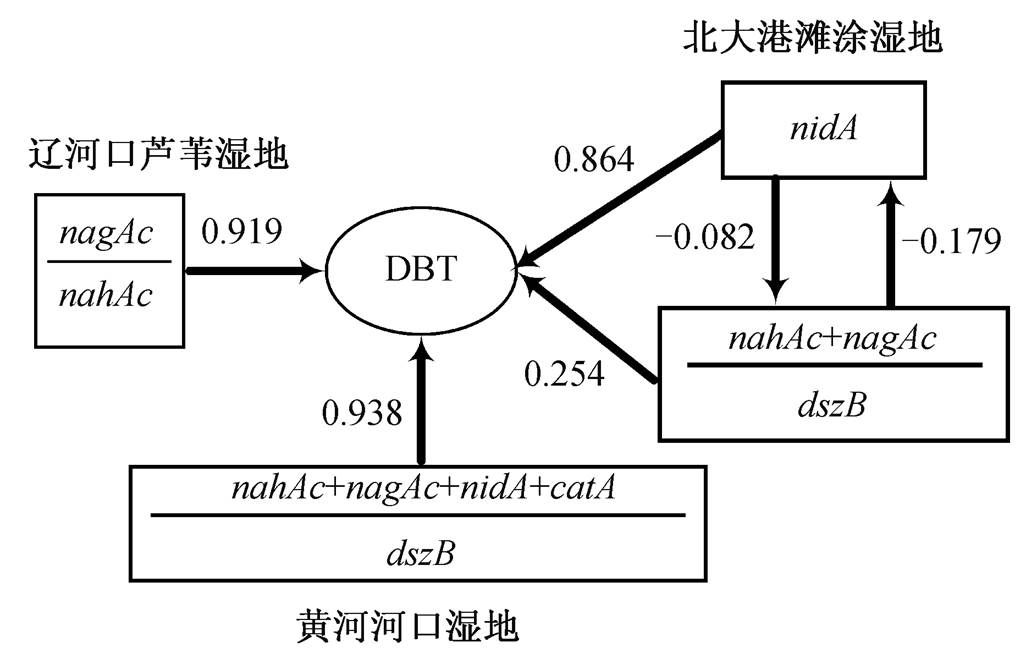
图7 不同湿地沉积物二苯并噻吩降解通径
Fig. 7 Degradation pathway of DBT degradation in different types of wetland
温度对降解DBT的影响较大, 为了研究不同温度条件下沉积物对DBT的降解功能基因作用及相应关系, 构建低温条件下(4ºC和10ºC)和中温条件下(20ºC和30ºC)DBT降解量与相关功能基因之间的Pearson相关系数矩阵。由得出的相关系数可知, 在低温条件下, DBT降解量并不与某一特定功能基因有相关性。尽管在低温条件下仍然存在可以降解多环芳烃的相关菌种, 但其生长繁殖能力及功能基因活性均受到严重影响。有研究者从南极沉积物中分离出22株耐低温的多环芳烃降解菌, 并对其进行培养, 其双加氧酶活性最高时的温度与常温菌种几乎相同, 都是在28~32ºC活性最高 [29] 。从冲绳海槽深海沉积物中分离得到的一株能降解萘的海洋低温细菌 Nah- 1, 在8ºC时菌群几乎不生长 [30] 。在低温条件下, 降解菌的生长和降解酶的活性都受到抑制, 没有一种理想的功能基因与DBT的降解有响应关系, 在中温条件下, DBT的降解量与 nidA 基因有一定的相关性, 说明中温条件下Kodama途径占主要优势地位, 且 nidA 基因在降解过程中起决定性作用。
以DBT降解速率为因变量, 以 nahAc , nagAc , nidA , catA 和 dszB 功能基因的绝对丰度及相对丰度为自变量, 运用SPSS软件进行统计分析, 建立逐步回归方程, 并计算影响系数, 结果如表 4 和图 8 所示。在低温条件下, nagAc 与 nahAc 的比值对DBT的降解起关键性的作用, 影响系数为0.605, 说明携带这两个基因的菌群可能更适合在低温条件下降解DBT。从北极海洋中分离得到的一株北极嗜冷假单胞菌可以在低温条件下降解菲、萘等多环芳烃, 对其功能基因的PCR扩增表明, 它与 nahAc 的基因片段具有较高的同源性 [30] 。在中温条件下, nidA 在降解DBT过程中贡献较大, 影响系数为0.679, 说明在高温条件下, 携带 nidA 基因的、既能降解低环芳烃又能降解高环芳烃的菌种适应性较强。无论是低温或中温条件, Kodama途径均是DBT降解的主要途径。4S 途径虽然对 DBT 的降解有一定的作用, 但通过方程无法拟合出线性关系。研究表明, 目前从自然界分离到的野生型 4S 途径降解菌多为 DBT 专一性降解菌, 大都不能通过正十二烷、正十六烷和萘为碳源进行代谢 [31] , 因此 4S 途径脱硫菌可能在自然湿地沉积物内降解DBT的菌群中不占优势地位。相比之下, 由于具有代谢碳的能力, Kodama途径在湿地沉积物降解DBT的途径中占优势地位。
表4 不同温度下DBT降解逐步回归方程
Table 4 Stepwise regression equations of DBT degradation at different temperatures

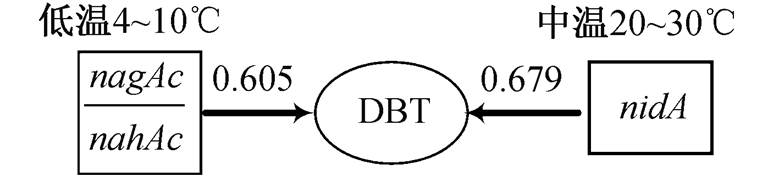
图8 不同温度条件下二苯并噻吩降解途径
Fig. 8 Degradation pathway of DBT degradation at different temperatures
本文选择辽河口芦苇湿地、北大港滩涂湿地和黄河河口湿地的 3 种不同湿地沉积物, 在模拟四季温度条件下培养 56 天, 测定DBT的降解效率, 分析DBT 降解功能基因的丰度, 建立DBT降解效率与功能基因群组定量响应关系模型, 得到以下结论。
1)沉积物降解实验中, 温度对DBT的降解率影响较大。4ºC培养时, DBT降解率排序为黄河河口湿地>北大港滩涂湿地>辽河口芦苇湿地, 30ºC培养时DBT降解率排序为北大港滩涂湿地>黄河河口湿地>辽河口芦苇湿地。
2)随着温度升高, 细菌及相关降解功能基因的丰度均有不同程度的变化。从降解功能基因组成上看, 黄河河口湿地沉积物中降解功能基因组成与其他两处不同, 其中代表4S途径的 dszB 基因丰度含量较高, 代表Kodama途径的标志基因 nahAc , nagAc , nidA 和 catA 丰度则明显低于其他两种湿地沉积物。
3)不同温度、不同湿地沉积物中降解DBT功能基因的作用不尽相同。总体而言, catA 和 dszB 基因影响DBT的降解速率。在辽河口芦苇湿地沉积物及低温条件下, nagAc/nahAc 基因对DBT的降解有较好的响应关系。在北大港滩涂湿地沉积物及高温条件下, nidA 基因对DBT的降解有较好的响应关系。黄河河口湿地沉积物中Kodama途径及4S途径功能 基因共同对DBT的降解有响应关系。总体而言, Kodama途径是湿地沉积物在自然条件下降解DBT的主要途径, 4S途径也有一定的作用。
参考文献
[1]刘成, 王兆印, 何耘, 等. 环渤海湾诸河口水质现状的分析. 环境污染与防治, 2003, 25(4): 222–225
[2]Escalante-Espinosa E, Gallegos-Martínez M E, Favela-Torres E, et al. Improvement of the hydrocarbon phytoremediation rate by Cyperus laxus Lam. inoculated with a microbialconsortium in a model system. Che-mosphere, 2005, 59(3): 405–413
[3]Adlard E R, Creaser L F, Matthews P H D. Identification of hydrocarbon pollutants on seas and beaches by gas chromatography. Anal Chem, 1972, 44: 64–67
[4]Kodama K, Umehara K, Shimizu K, et al. Identifi-cation of microbial products from dibenzothiophene and its proposed oxidation pathway. Agricultural & Biological Chemistry, 1973, 37(1): 45–50
[5]Li G Q, Li S S, Zhang M L, et al. Genetic rearrange-ment strategy for optimizing the dibenzo thiophene biodesulfurization pathway in Rhodococcus erythro-polis. Applied & Environmental Microbiology, 2008, 74(4): 971–976
[6]Cao X X, Tian Y, Hu Z, et al. Research progress in PAHs degradation genes and enzymes. Chinese Jour-nal of Ecology, 2007, 26(6): 917–924
[7]Honda H, Sugiyama H. High cell density of Rhodoco-ccus rhodochrous by pH-stat feeding and dibenzo-thiophene degradation. Ferment. Bioeng, 1998, 85(3): 334–338
[8]Castorena G, Suarez C, Valdez I, et al. Sulfur-selective desulfurization of dibenzothiophene and diesel oil by newly isolated Rhodococcus sp. strains. FEMS Microbiology Letters, 2002, 215(9): 157–161
[9]Kaufman E N, Harkins J B, Borole A P. Comparison of batchstirred and electrospray reactors for biodesul-furization of dibenzothiophene in crude oil and hydrocarbon feedstocks. Applied Biochemistry and Biotechnology, 1998, 73(2): 127–144
[10]Kodama K. Co-metabolism of dibenzothiophene by pseudomonas jianii . Bioscience Biotechnology & Biochemistry, 2008, 41(7): 1305–1306
[11]Li Lin, Zhao Chaocheng, Liu Qiyou, et al. Op-timization for microbial degradation of dibenzo-thiophene by pseudomonas sp. LKY-5 using response surface methodology. China Petroleum Processing & Petrochemical Technology, 2014, 16(1): 19–26
[12]Khedkar S, Shanker R. Degradation of dibenzothio-phene and its metabolite 3-hydroxy-2-formylbenzo-thiophene by an environmental isolate. Biodegradation, 2014, 25(5): 643–654
[13]聂麦茜, 张志杰. 环境中多环芳烃污染规律及其生物净化技术. 环境导报, 2001(1): 18–21
[14]刁春燕, 周启星, 周俊良, 等. 土壤、沉积物和植物样品中多环芳烃(PAHs)不同提取与净化方法比较. 农业环境科学学报, 2011, 30(12): 2399–2407
[15]Bordoloi N K, Bhagowati P, Chaudhuri M K, et al. Proteomics and metabolomics analyses to elucidate the desulfurization pathway of Chelatococcus sp. Plos One, 2016, 11(4): e0153547
[16]Park J W, Crowley D E. Dynamic changes in nahAc gene copy numbers during degradation of naphthalene in PAH-contaminated soils. Applied Microbiology and Biotechnology, 2006, 72(6): 1322–1329
[17]Patoux J, Foster R C, Brown R A. Dynamic changes in functional gene copy numbers and microbial communities during degradation of pyrene in soils. Environmental Pollution, 2010, 158(9): 2872–2879
[18]Cébron A, Norini M P, Beguiristain T, et al. Real-time PCR quantification of PAH-ring hydroxylating dioxygenase (PAH-RHD α) genes from Gram positive and Gram negative bacteria in soil and sediment samples. Journal of Microbiological Methods, 2008, 73(2): 148–159
[19]Furuya T, Takahashi S, Ishii Y, et al. Cloning of a gene encoding flavin reductase coupling with dibenzo-thiophene monooxygenase through coexpression screening using indigo production as selective indi-cation. Biochemical & Biophysical Research Commu-nications, 2004, 313(3): 570–575
[20]侯影飞, 孔瑛, 郭宁, 等. 二苯并噻吩生物降解菌培养和反应条件的优化. 中国石油大学学报(自然科学版), 2008, 32(6): 138–141
[21]Geiselbrecht A D, Hervig P, Deming J W, et al. E-numeration and phylogenetic analysis of polycyclic aromatic hy-drocarbon degrading marine bacteria from Puget Sound sediments. Appl Environ Micro-biol, 1996, 62(9): 3344–3349
[22]张书颖, 谢曙光. 菲厌氧降解对细菌和古细菌群落的影响. 北京大学学报(自然科学版), 2011, 47(5): 923–928
[23]Liu Y, Beckingham B, Ruegner H, et al. Detection of polycyclic aromatic hydrocarbon (PAH) degradation genes in polluted soil by DNA extraction and colony hybridization. Fresenius Environmental Bulletin 2008, 17(4): 478–485
[24]Vázquez S, Nogales B, Ruberto L, et al. Bacterial community dynamics during bioremediation of diesel oil-contaminated Antarctic soil. Microbial Ecology, 2009, 57(4): 598–610
[25]El A N, Devers-Lamrani M, Chatagnier G, et al. Molecular analysis of the catechol-degrading bacterial community in a coal wasteland heavily contaminated with PAHs. Journal of Hazardous Materials, 2010, 177: 593–601
[26]Khan A A, Wang R F, Cao W W, et al. Molecular Cloning, Nucleotide Sequence, and Expression of Genes encoding a polycyclic aromatic ring dio-xygenase from, Mycobacterium sp. Strain PYR-1. Applied and Environmental Microbiology, 2001, 67 (8): 3577–3585
[27]周宏伟, 吴锦雅. 氮磷营养元素对多环芳烃降解的影响研究. 科技咨询导报, 2007(22): 2–3
[28]Singleton D R, Ramirez L G, Aitken M D. Characteri-zation of a polycyclic aromatic hydrocarbon degra-dation gene cluster in a phenanthrene-degrading acidovorax strain. Applied & Environmental Micro-biology, 2009, 75(9): 2613–2620
[29]马迎飞. 南极沉积物中多环芳烃(PAHs)降解菌的研究: 分离、鉴定和降解基因的检测[D]. 泰安: 山东农业大学, 2004
[30]Kim S J, Kweon O, Jones R C, et al. Complete and integrated pyrene degradation pathway in Mycobacte- rium vanbaalenii PYR-1 based on systems biology. Journal of Bacteriology, 2007, 189(2): 464–472
[31]Caro A, Boltes K, Letón P, et al. Dibenzothiophene biodesulfurization in resting cell conditions by aerobic bacteria. Biochemical Engineering Journal, 2007, 35 (2): 191–197
A Study on the Response Relationships between Degradation Rate and Degradation Functional Genes of Dibenzothiophene in Bohai Rim Typical Wetland Sediments at Different Temperatures
HUANG Siqiao, JI Guodong †
The key Laboratory of Water and Sediment Sciences (MOE), Department of Environmental Engineering, Peking University, Beijing 100871
Abstract In order to reveal the dibenzothiophene (DBT) degradation pathway in Bohai Rim typical wetland sediments at different temperatures, three different types of wetland sediments were chosen: reed wetland sediments (RWS) collected from Liao River estuary, tidal wetlands sediments (TWS) collected from Beida harbor and estuary wetland sediments (EWS) collected from Yellow River estuary. These samples were cultured for 56 days under the condition of simulating the seasonal temperature. The degradation rates were determined and the abundance of DBT degradation functional genes were analyzed. The DBT degradation pathways in different wetland sediments and at different temperatures were analyzed using a quantitative response model established between DBT degradation rate and degradation functional gene groups. Results show that the degradation rate and the abundance of degradation functional genes are basically improved with the increase of temperature. At 4ºC, the trend of DBT degradation rate is EWS>TWS>RWS; while at 30ºC, it is TWS>EWS>RWS. Functional genes catA and dszB affect DBT degradation rate. Kodama pathway functional genes nagAc/nahAc and nidA are the main functional genes for DBT degradation in all the three typies of wetland sediments at low temperature while nidA is the the main at medium temperature. The 4S pathway gene dszB plays an important role for DBT degradation.
Key words dibenzothiophene; wetland sediments; Bohai Rim; functional genes; degradation pathway
doi: 10.13209/j.0479-8023.2017.185
中图分类号 X172
收稿日期: 2017-04-05;
修回日期: 2017-04-12;
网络出版日期: 2018-01-05
†通信作者 , E-mail: jiguodong@pku.edu.cn
† Corresponding author , E-mail: jiguodong@pku.edu.cn
国家自然科学基金(51679001)资助