
1. 丹江口坝下(32.51°N, 111.51°E); 2. 陶岔(32.66°N, 111.66°E); 3. 襄阳(32.03°N, 112.15°E); 4. 仙桃(30.38°N, 113.45°E); 5. 集家嘴(30.57°N, 114.23°E)
图1 研究区域及采样点
Fig. 1 Research area and sampling sites
刘清香 1,2 王婷 1,2 许旭明 1,2 倪晋仁 1,2,†
1.北京大学深圳研究生院环境与能源学院, 深圳 518055; 2.北京大学环境工程系, 教育部水沙科学重点实验室, 北京 100871
摘要 为研究汉江中下游水体和沉积物硅藻的时空分布特征及其影响因素, 于2014年春、秋两季对汉江中下游5个监测断面的硅藻群落进行监测。基于18S rRNA Illumina Miseq高通量测序技术的鉴定结果, 共得到硅藻3纲28目49科111属160种, 其中沉积物硅藻占98.6%。物种丰度显著多于已有研究的结果, 体现了高通量测序技术在硅藻物种鉴定上的优势。水体和沉积物硅藻群落组成和优势种有显著差异, 水体中硅藻优势种为 Pinnularia , Cyclotella 和 Nitzschia , 沉积物中硅藻优势种为 Pinnularia , Nitzschia 和 Navicula 。汉江中下游硅藻群落多样性的时空差异明显, 硅藻多样性存在空间异质性, 且沉积物硅藻比水体硅藻多样性丰富; 在季节影响方面, 表现为秋季硅藻物种多样性比春季丰富。总氮、氨氮、硝态氮和总磷等环境因素对硅藻群落组成影响较大, 因此氮磷控制对避免汉江中下游硅藻水华发生具有重要意义。
关键词 高通量测序; 汉江; 硅藻; 时空分布; 环境因子
硅藻是种类最多的一种浮游植物, 现存物种数量为30000~100000种 [1] , 能提供的初级生产力约占全球的1/4 [2] 。河流中硅藻的密度和生物量可达到藻类总数的60%以上 [3] 。硅藻繁殖率高, 生命周期短, 对水体中环境因子(温度、酸碱度、电导率和营养盐等)的变化能快速做出响应 [4] , 因此成为河流监测和评价的重要指示生物 [5] 。然而, 一些硅藻(如冠盘藻、小环藻和直链藻等)是河流水华的优势种 [6–8] , 严重破坏了河流生态系统的稳定性。对河流系统中硅藻的群落进行鉴定, 对全新地认识和开发河流以及维护河流健康有重要意义。
硅藻的鉴定方法主要有传统形态学鉴定和分子生物学法。形态学鉴定法依据细胞表面特征(如大小、形状和内部结构等)的差异进行分类。然而, 对于一些以单细胞形式存在、细胞尺寸较小的硅藻, 形态学鉴定方法不够准确, 且易受环境因素和营养条件等的影响 [3] 。基于高通量测序技术(high-throughput sequencing)的分子生物学鉴定方法能一次对几十万到几百万条DNA分子进行并行测序, 随着测序技术的发展, 以Illumina测序平台为基础的分子生物学鉴定技术在藻类研究领域中开始广泛应用, 为藻类分类鉴定提供了更准确的方法, 弥补了传统形态学鉴定方法的缺陷。目前, 基于硅藻 18S rDNA的高通量测序技术已有大量报道 [9–12] 。
汉江流经陕西、湖北两省, 是国家“长江经济带”的有机组成部分。受经济发展及污水大量排放的影响, 汉江中下游硅藻水华现象日益突出。然而, 当前研究主要从形态学角度分析浮游硅藻引起的水华 [13–19] , 从分子水平分析硅藻群落的研究较少, 且未见汉江中下游表层沉积物硅藻的报道 [20] 。本研究基于Illumina Miseq高通量测序技术, 选择18S rRNA基因序列, 开展汉江中下游硅藻时空分布及其与环境因子关系的研究, 克服了形态学分析方法主观因素影响较大、分析不够准确的缺点, 可为汉江中下游硅藻的分布特征提供基础数据资料, 也为开发利用和保护汉江中下游水资源与水环境提供一定理论依据。
汉江是长江第一大支流, 发源于陕西省秦岭南麓, 在武汉龙王庙汇入长江。丹江口至钟祥河段为中游, 河道长270 km, 流域面积为4.68×10 4 km 2 。钟祥至汉口龙王庙为下游, 流经江汉平原, 河道长382 km, 流域面积为1.7×10 4 km 2 。汉江流域气候温和, 平均气温为16°C, 年平均降水量为700~1300 mm, 多集中在5—10月。径流量年际变化较大, 丰水年平均流量为3310m 3 /s, 枯水年平均流量为572 m 3 /s [13] 。汉江沿途接纳工业废水和市镇污水约7亿t/a, 水体富营养化严重, 容易发生水华 [14] , 水华的主要优势种是硅藻。
根据汉江中下游的水体形态, 设置 5 个采样点(图 1), 于 2014 年 3 月(春季)和 10 月(秋季)分别对水体和沉积物进行采集。水样利用采水器进行采集, 为河道三线九点等体积混合水; 在同一断面使用采泥器采集表层沉积物样品。样品分别标记为SW(春季水样)、SS(春季沉积物)、FW(秋季水样)和FS(秋季沉积物)。基于化石硅藻的推理模型, 本研究选取的时间段可获得最具代表性的硅藻环境样品 [21] 。
采集的水样分为两份, 其中一份用于硅藻的分子生物学鉴定, 另一份用于水化学指标分析。
用于硅藻分子生物学鉴定的水样于24小时之内用0.22 μm聚碳酸酯滤膜(Millipore, USA)过滤后保留滤膜, 再用FastDNA SPIN Kit for Soil试剂盒提取DNA。沉积物样品离心去水后, 采用同样的方式提取DNA。每个样本进行3~5次DNA抽提并进行混合, 组成该样本的DNA样品。吸取5μLDNA样品, 用0.8%的琼脂糖凝胶电泳检测DNA的完整性, 用Nanodrop 2000进行定量。在对DNA样品进行PCR扩增时, 参照Visco等 [12] 的方法, 对18S rRNA的V4区进行PCR扩增(ABI GeneAmp ® 9700型), 然后使用AxyPrepDNA凝胶回收试剂盒(AXYGEN, USA), 切胶回收PCR产物, Tris_HCl洗脱; 2%琼脂糖电泳检测。最后, 由上海美吉生物医药科技有限公司构建18S rRNA基因V4区测序文库, 并进行Illumina Miseq测序。

1. 丹江口坝下(32.51°N, 111.51°E); 2. 陶岔(32.66°N, 111.66°E); 3. 襄阳(32.03°N, 112.15°E); 4. 仙桃(30.38°N, 113.45°E); 5. 集家嘴(30.57°N, 114.23°E)
图1 研究区域及采样点
Fig. 1 Research area and sampling sites
硅藻鉴定分类参照美国国家生物技术信息中心(NCBI)和Medlin等 [22] 的分类方法, 将硅藻门分为 Coscinodiscophytina 亚门和 Bacillariophytina 亚门, 其中 Coscinodiscophytina 亚门下属硅藻纲( Coscino- discophyceae ), Bacillariophytina 亚门下属硅藻纲( Bacillariophyceae )和中型硅藻纲( Mediophyceae )。
另一部分水样用于检测水体的电导率(Cond)、pH、总氮(TN)、总磷(TP)、氨氮(NH 3 -N)、硝氮(NO 3 -N)、COD和溶解氧(DO)等指标, 检测方法参考HJ/T91-2002《地表水和污水检测技术规范》。
为分析硅藻的多样性及时空分布差异, 本研究采用的统计分析方法包括多样性分析、NMDS分析、LEfSe分析和Heatmap分析。
采用MOTHUR 软件计算样品的 OUT (opera-tional taxonomic unit)丰度和Shannon多样性指数。利用 Shannon 指数评估群落物种多样性( α 多样 性), Shannon 值越大, 说明群落多样性越高。覆盖率(Coverage)指数用于评价样品的覆盖度和测序深度是否足够, Coverage 数值越大, 表明样品中所有物种被测出来的概率越大, 没有被测出来的物种越少。
非度量多维尺度分析(NMDS)方法根据水体和沉积物硅藻的时空分布, 分析可视化所有样品两两间的Unweighted-UinFrac距离, 进而分析因硅藻群落组成时空差异而产生的 β 多样性。
LEfSe(linear discriminant analysis effect size)分析方法主要是通过Kruskal-Wallis参数因子和秩验检来实现。根据分类学组成, 按照不同的分组条件, 对样品进行线性判别分析(LDA), 找出对样品划分产生显著性差异影响的群落或物种。
相关性Heatmap分析方法通过计算各环境因子与所选物种或OTU之间的相关性(Pearson系数), 用颜色梯度来反映物种与环境因子的相关性, 进而揭示影响硅藻物种多样性与丰度的关键环境因子。
各个样本的Coverage指数范围为99.39%~99.79%, 平均值为99.50%, 证明样本中几乎所有的硅藻信息均被检测出。此次调查共得到1436个OTU, 春季水样、春季沉积物、秋季水样和秋季沉积物样品分别含479, 855, 626和879个OTU, 4组样品共有的OTU为247个。对每个OTU进行从门到种的注释, 鉴定硅藻共3纲28目49科111属160种, 其中春季28目47科101属139种, 秋季28目49科102属148种, 比形态学鉴定的物种数 [13,17,23] 多, 表明高通量测序技术对硅藻多样性的鉴定更全面, 可对现有物种鉴定方法进行有效的补充。采集的样品中, 沉积物硅藻占总物种数的98.6%, 表明沉积物是长江生态系统硅藻物种的存储库。
在属水平上, 丰度居前30的物种占总数的97.2%, 因此本研究选择该范围的物种分布来分析春季水体、春季沉积物、秋季水体和秋季沉积物的硅藻群落结构, 结果如图2所示。水体硅藻的优势种为 Pinnularia , Cyclotella 和 Nitzschia , 占比分别达到24.1%~40.3%, 1.2%~9.1%和1.1%~8.3%, 其次为 Plagiogrammopsis , Aulacoseira , Navicula , Asterionella , Porosira , Thalassiosira 和 Cyclostephanos 。沉积物优势种为 Pinnularia , Nitzschia 和 Navicula , 占比分别达到12.2%~29.8%, 3.5%~13.7%和1.9%~5.2%, 其次为 Sellaphora , Cyclotella , Surirella , Cymatopleura , Aul-acoseira , Porosira 和 Amphora 等。此外, 尚未分类部分的物种(Environmental_samples_norank)达到15.3%~49.8%, 说明自然环境中尚有很多未知硅藻会不断被发现 [1] , 其分类体系还需不断完善。
大量研究表明, 引起汉江硅藻水华的优势物种为小环藻属( Cyclotella ) [13] , 而郑凌凌 [19] 结合形态学和分子生物学方法研究得到的硅藻水华优势种为直链藻属( Aulacoseira )和冠盘藻属( Stephanodiscus )。本研究得到的汉江中下游硅藻优势种为羽纹藻属( Pinnularia )、菱形藻属( Nitzschia )和小环藻属( Cy- clotella ), 与已有研究结果有所不同, 可能得益于水环境污染治理的加强, 使汉江中下游水体中氮磷等营养盐浓度降低, 硅藻水华现象得到很大程度的缓解, 硅藻优势种也随之变化。
汉江中下游春季水体、春季沉积物、秋季水体和秋季沉积物中硅藻的Shannon多样性指数变化范围分别为2.45~3.07, 2.88~3.82, 2.96~3.57和3.42~4.26。图3和4分别反映各个采样点的Shannon多样性指数变化和水环境因子的变化。

图2 汉江中下游水体和沉积物硅藻的时空分布(属水平)
Fig. 2 Spatiotemporal distribution of diatoms in water and sediment of middle and lower reaches of Hanjiang River (Genus level)
从图3可以看出, 不同季节水体和沉积物浮游硅藻Shannon多样性指数的空间变化趋势一致, 即水体硅藻多样性指数高的断面对应的沉积物硅藻多样性指数也高, 说明硅藻多样性在空间上存在一定的异质性。从不同生境来比较, 沉积物硅藻的Shannon多样性指数比水体大, 这与Feng等 [24] 对细菌群落的研究结果一致。从季节变化上来看, 秋季硅藻Shannon多样性指数比春季大。从图4可知, 春季水温和总磷偏低, 不适于硅藻的生长; 而秋季气温高且降水量大, 更适合大部分种类藻类的繁殖和生长。
不同采样断面之间横向比较, 春季陶岔硅藻的Shannon多样性指数最大(图3), 可能是由于陶岔的水温和电导率均较高(图4), 适合更多硅藻的生 长 [25] 。与春季不同的是, 秋季集家嘴的硅藻物种多样性指数最高(图3), 这是由于集家嘴总氮、硝态氮和COD显著升高(图4), 对沉积物硅藻的影响较大 [26] 。
研究表明, 硅藻水华生长的最佳温度为20°C, 此时细胞分裂及色素积累较快, 光合作用合成的产物含量高 [19] 。统计结果显示, 1992—2000年汉江下游的5次“硅藻水华”事件均发生在春季, 这与春季磷、氮等营养物质严重超标有关 [19,27] 。本研究在春季采样时, 除襄阳外的站点水温均低于10°C, 且氮、磷浓度不高。因此, 本研究中春季硅藻未达到水华程度, 且春季相对丰度比秋季低。Tan等 [26] 对汉江上游硅藻物种丰度的研究与本文结论一致。

图3 汉江中下游水体和沉积物藻类香农多样性指数变化
Fig. 3 Variation of Shannon’s diversity index of diatoms in water and sediment along middle and lower reaches of Hanjiang River
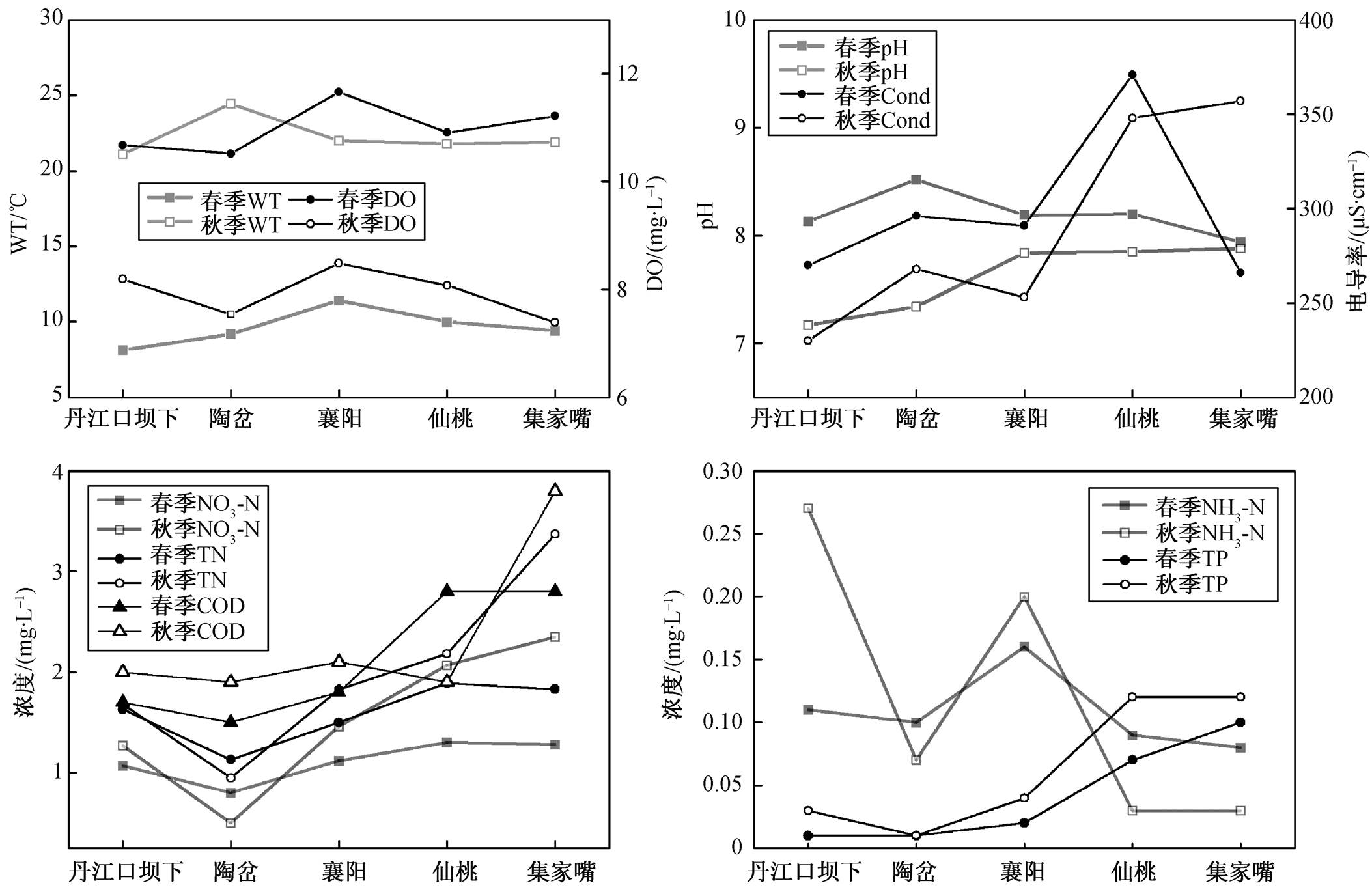
图4 汉江中下游环境因子变化
Fig. 4 Change of environmental factors along middle and lower reaches of Hanjiang River
为研究汉江中下游水体和沉积物硅藻群落的分布特征及变化规律, 对样品进行NMDS分析, 结果如图5所示。在NMDS1轴方向, 水样与沉积物样品明显分开, 表明水体与沉积物硅藻的群落组成存在显著差异。由此说明, 生境类型是影响硅藻群落组成的重要因素, 这与Feng等 [24] 对细菌的研究结论一致。从NMDS2轴来看, 春季与秋季的水样分别聚成两组, 而春季与秋季的沉积物样品没有明显分开, 即水样硅藻群落组成具有较大的季节性差异, 而沉积物硅藻群落组成季节差异性小。这是因为影响水体硅藻生长的重要环境因素(如流量、pH、电导率、总氮和总磷等)随季节变化较大 [25,28–33] , 而沉积物的相对稳定性导致其受这些环境因子的影响较小, 因此沉积物硅藻群落的季节差异性相对较小。
由于4组样品(春季水样、春季沉积物、秋季水样和秋季沉积物)具有一定的差异性, 为了进一步识别不同组别中丰度有显著差异的物种, 选定LDA 判别阈值(LDA score)为4。通过分析LDA值的分布得到春季沉积物、秋季沉积物、秋季水样和春季水样的生物标记物分别为13, 9, 8和2个。由此可以看出, 沉积物中的生物标志物比水中多, 可能是由沉积物不具流动性而具有明显的空间异质性导致的。水体中, 秋季的生物标志物比春季多, 可能是由于秋季各个环境因子的变化较大所致。在差异性物种中, 秋季沉积物中的硅藻纲( Bacillariophyceae )对硅藻群落的影响力最大, 其次是春季水样中的冠盘藻属( Stephanodiscus ) 。
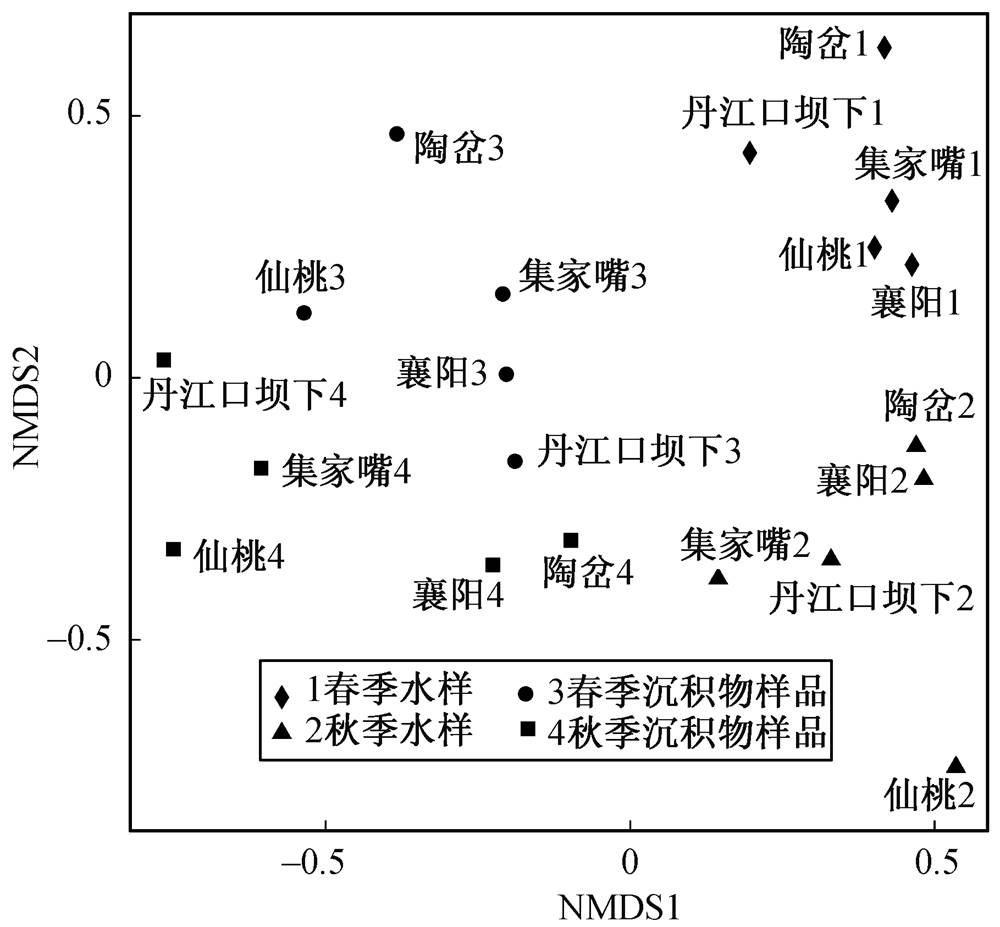
图5 汉江水体和沉积物样品的NMDS分析
Fig. 5 NMDS analysis of samples in water and sediment of Hanjiang River

图6 硅藻群落的显著性差异物种的标识
Fig. 6 Identity of diatom genus with significant difference between differences groups
图6为差异性物种在系统发育下的进化分支图, 由内至外辐射状地展示从门至属的分类, 圆圈直径与相对丰度呈正比。由图6可知, 春季沉积物硅藻中, 生物标记物是4个目( Achnanthales , Bacillario- phycidae , Surirellales 和 Coscinodiscophycida e ); 秋季沉积物硅藻中, 生物标记物有 Bacillariophyceae 纲, 特别是 Bacillariales 目。其中, 秋季沉积物中 Bacillariophyceae 纲和沉积物中 Achnanthales 目的相对丰度较大。
为研究硅藻物种与环境因子的相关性, 本研究选择相对丰度居前50的物种(属水平)以及9个环境因子(WT, DO, pH, Cond, NH 3 -N, NO 3 -N, TN, TP和COD), 绘制相关性Heatmap图和聚类树分析图(图7), 分析硅藻群落对环境因子的响应。图7中红色表示正相关, 蓝色表示负相关, 星号代表显著性(1个星号代表0.05显著性水平, 2个星号代表0.01显著性水平, 3个星号代表0.001显著性水平)。
由图7可知, 硅藻不同物种对pH和DO的响应基本上一致, 对水温的响应则相反。这是因为水温越高, 溶解氧越低。 Aulacoseira , Urosolenia , Encyonema , Caloneis , Achnanthidium , Bacillaria , Cyclostephanos ,
Epithemia , Stephanodiscus , Sellaphora 和 Cymatopleura 等硅藻物种适于在偏碱性的低温环境下生存, 尤其是冠盘藻属的 Stephanodiscus ; 而 Skeletonema , Con- ticribra , Entomoneis , Craticula , Cocconeis , Gompho- nema , Synedra , Planothidium 和 Geissleria 等更适于在偏酸性的高温环境下生存。
pH对藻类代谢生长有重要影响 [34] , 根据代谢情况, 可将硅藻分为酸性、嗜酸性、中间型、嗜碱性和碱性生物型 [31] 。温度对硅藻物种的影响也较显著, Stephanodiscus 与温度显著负相关, Cyclotella 与温度正相关。硅藻可以分为低温种、高温种和中温种, 大部分硅藻的适宜温度范围为15~25°C [35] , 大部分小环藻的适宜温度为30~40°C, 也有部分小环藻、直链藻和脆杆藻(如 Cyclotella stelligera. , Aulacoseira distans var . tenella , A. ambigua , Fra - gilaria pinnata )在温度较低的环境下生长 [21,30] 。 Cyclotella meneghiniana 在13~25°C下随温度升高呈线性增长 [28] , 最佳温度为23°C [29] 。电导率是影响硅藻群落组成的重要因素, 不同硅藻物种对电导率的敏感程度不同, 这与Potapova等 [32–33] 的研究结果一致。研究表明, 适宜的水温、电导率、pH和氮磷营养盐对硅藻的生长至关重要 [4,25,36] 。
生源物质对硅藻群落也有重要影响。大部分硅藻物种对COD有响应, 特别是 Porosira 和 Plagiogra- mmopsis 与COD显著正相关。这是因为不同藻类利用碳元素的形式不同, 且这两类硅藻对有机碳源的需求较大 [37] 。总磷与大部分硅藻物种有较显著的相关性, Cyclotella 和 Porosira 与总磷显著正相关; 而部分硅藻与总磷负相关, 可能是由于硅藻可利用的磷源(如磷酸钠盐, 磷酸钾盐或磷酸钙盐等)较少。不同硅藻群落对不同形态的氮源响应也不同 [34,38] , Nitzschia , Surirella , Cyclotella , Porosira , Plagiogram- mopsis , Skeletonema 和 Conticribra 与总氮及硝态氮均显著正相关, 因为这些硅藻主要以硝态氮为氮源; Fragilaria , Cocconeis , Gomphonema , Synedra , Planothidium 和 Geissleria 主要利用氨氮, 因此与氨氮显著正相关。已有研究表明, 在一定浓度范围内, 小环藻和脆杆藻(如 Cyclotella stelligera , Fragilaria pinnata var. lancettula )的丰度与NO 3 − 的浓度成正 比 [21] 。Tan等 [26] 证明氮素(NH 4 + -N, NO 3 -N, TN)和COD对硅藻群落的组成影响较大。本研究发现, Cyclotella 的丰度与硝态氮浓度呈正比, 而 Fragilaria 丰度与硝态氮呈弱负相关, 与氨氮浓度显著正相关。基于生源物质氮和磷对硅藻群落多样性的显著影响, 本研究认为, 控制汉江中下游的水体氮磷浓度对避免硅藻水华发生有重要意义。
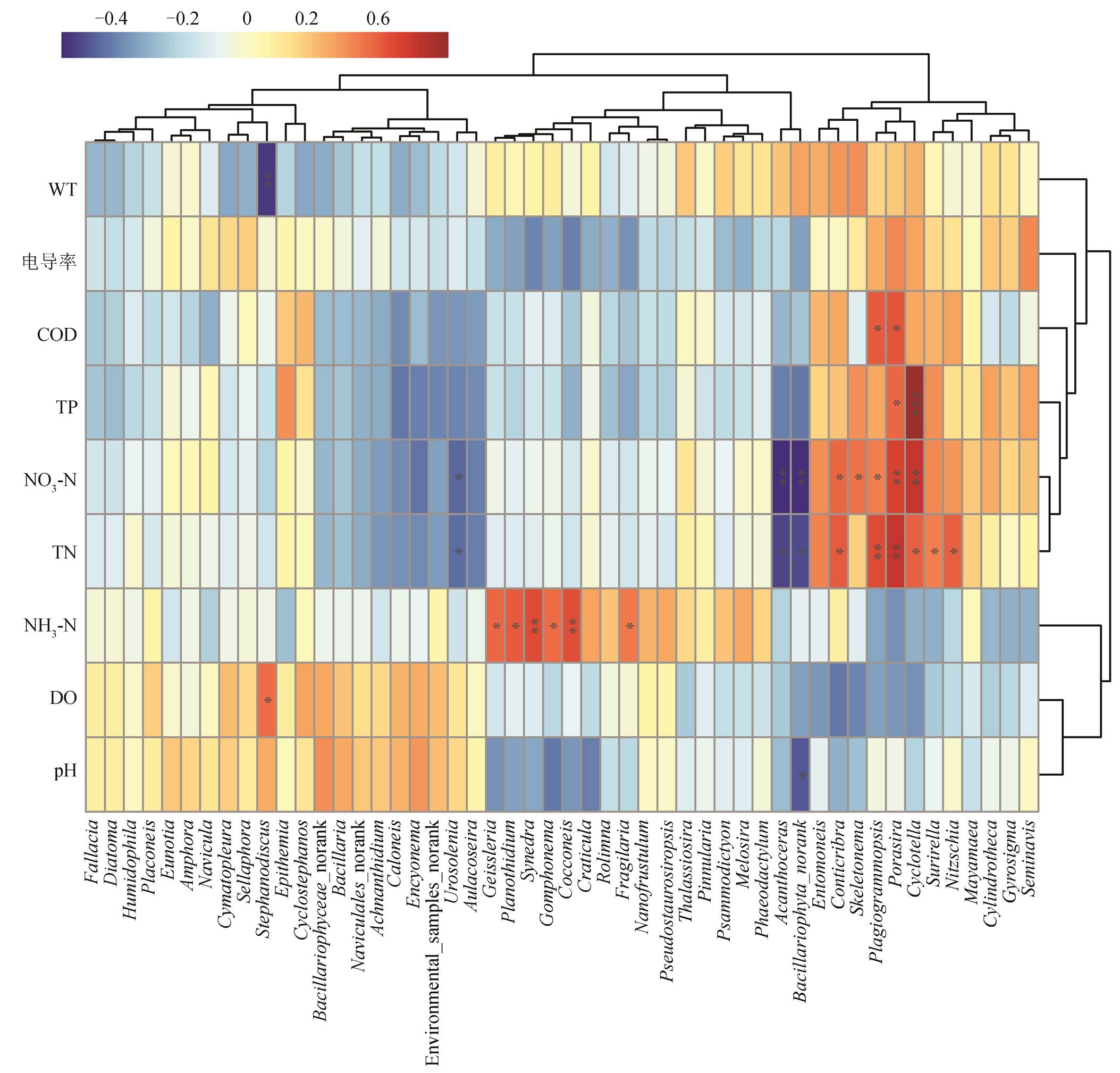
图7 硅藻物种与环境因子的相关性Heatmap图和聚类树分析
Fig. 7 Correlation heatmap and clustering tree analysis between diatoms genuses and environmental factors
采用18S rRNA Illumina Miseq高通量测序技术, 鉴定得到汉江中下游水样和沉积物硅藻共 4 纲28 目 49 科 111 属 160 种, 其中春季 28 目 47 科 101属 139 种, 秋季 28 目 49 科 102 属 148 种。沉积物硅藻占总物种数的 98.6%, 表明沉积物是长江生态系统硅藻物种的存储库。水体硅藻的优势种是 Pinnularia , Cyclotella 和 Nitzschia , 而沉积物中的优势种是 Pinnularia , Nitzschia 和 Navicula 。
汉江中下游硅藻的Shannon多样性指数变化范围为 2.45~4.26, 沉积物硅藻 Shannon 多样性指数比水体大。在空间分布上, 硅藻多样性存在异质性; 不同季节水体硅藻多样性丰富的断面对应的沉积物硅藻多样性也丰富, 且沉积物硅藻比水体硅藻多样性丰富; 在季节影响方面, 秋季硅藻物种多样性比春季丰富。
水体和沉积物硅藻的群落组成存在显著差异。水样硅藻群落组成具有较大的季节性差异, 而沉积物硅藻群落组成季节差异性小。由此表明, 生境类型是影响硅藻群落组成的重要因素。
不同硅藻物种对同一环境环境因子的响应不一致。总氮、氨氮、硝态氮和总磷等营养盐对硅藻群落组成影响较大。因此, 控制汉江中下游的水体氮、磷浓度对避免硅藻水华发生有重要意义。
参考文献
[1]Mann D G, Vanormelingen P. An inordinate fondness? The number, distributions, and origins of diatom spe-cies. The Journal of Eukaryotic Microbiology, 2013, 60(4): 414–420
[2]Scala S, Bowler C. Molecular insights into the novel aspects of diatom biology. Cellular and Molecular Life Sciences, 2001, 58(11): 1666–1673
[3]张东, 隋正红, 王春燕, 等. 一株海洋微型硅藻的形态学和分子生物学鉴定. 海洋学报, 2010, 32(2): 168–173
[4]Leland H V. Distribution of phytobenthos in the Yakima River basin, Washington, in relation to geology, land use, and other environmental factors. Canadian Journal of Fisheries and Aquatic Sciences, 1995, 52(5): 1108–1129
[5]Bellinger B J, Cocquyt C, O’Reilly C M. Benthic diatoms as indicators of eutrophication in tropical streams. Hydrobiologia, 2006, 573(1): 75–87
[6]Kim D K, Jeong K S, Whigham P A, et al. Winter diatom blooms in a regulated river in South Korea: explanations based on evolutionary computation. Freshwater Biology, 2007, 52(10): 2021–2041
[7]Kiss K T, Genkal S I. Winter blooms of centric diatoms in the River Danube and in its side-arms near Budapest (Hungary). Hydrobiologia, 1993, 269(1): 317–325
[8]窦明, 谢平, 夏军, 等. 汉江水华问题研究. 水科学进展, 2002, 13(5): 557–561
[9]Evans K M, Wortley A H, Mann D G. An assessment of potential diatom “barcode” genes (cox1, rbcL, 18S and ITS rDNA) and their effectiveness in determining relationships in Sellaphora ( Bacillariophyta ). Protist, 2007, 158(3): 349–364
[10]Cheng J, Li Y, Liang J, et al. Morphological variability and genetic diversity in five species of Skeletonema ( Bacillariophyta ). Progress in Natural Science, 2008, 18(11): 1345–1355
[11]Moniz M B J, Kaczmarska I. Barcoding of diatoms: nuclear encoded ITS revisited. Protist, 2010, 161(1): 7–34
[12]Visco J A, Apotheloz-Perret-Gentil L, Cordonier A, et al. Environmental monitoring: inferring the diatom index from next-generation sequencing data.Environ-mental Science &Technology, 2015, 49(13): 7597–7605
[13]况琪军, 谭渝云, 万登榜, 等. 汉江中下游江段藻类现状调查及“水华”成因分析. 长江流域资源与环境, 2000, 9(1): 64–71
[14]梁开学, 王晓燕, 张德兵, 等. 汉江中下游硅藻水华形成条件及其防治对策. 环境科学与技术, 2012, 35(增刊2): 113–116
[15]殷大聪, 郑凌凌, 宋立荣. 汉江中下游早春冠盘藻( Stephanodiscus hantzschii )水华暴发过程及其成因初探. 长江流域资源与环境, 2011, 20(4): 451–458
[16]殷大聪, 黄薇, 吴兴华, 等. 汉江水华硅藻生物学特性初步研究. 长江科学院院报, 2012, 29(2): 6–10
[17]潘晓洁, 朱爱民, 郑志伟, 等. 汉江中下游春季浮游植物群落结构特征及其影响因素. 生态学杂志, 2014, 33(1): 33–40
[18]王培丽. 从水动力和营养角度探讨汉江硅藻水华发生机制的研究[D].武汉: 华中农业大学, 2010
[19]郑凌凌. 汉江硅藻水华优势种生理生态学研究[D]. 福州: 福建师范大学, 2005
[20]郑凌凌, 宋立荣, 吴兴华, 等. 汉江硅藻水华优势种的形态及 18SrDNA 序列分析. 水生生物学报, 2009, 33(3): 562–565
[21]Köster D, Pienitz R. Seasonal diatom variability and paleolimnological inferences — a case study. Journal of Paleolimnology, 2006, 35(2): 395–416
[22]Medlin L K, Kaczmarska I. Evolution of the diatoms: Ⅴ. Morphological and cytological support for the major clades and a taxonomic revision. Phycologia, 2004, 43(3): 245–270
[23]徐新伟, 吴中华, 于丹, 等. 汉江中下游水生植物多样性及南水北调工程对其影响. 生态学报, 2002, 22(11): 1933–1938
[24]Feng B W, Li X R, Wang J H, et al. Bacterial diversity of water and sediment in the Changjiang estuary and coastal area of the East China Sea. Fems Microbio-logy Ecology, 2009, 70(2): 236–248
[25]Chen X, Zhou W, Pickett S T A, et al. Diatoms are better indicators of urban stream conditions: a case study in Beijing, China. Ecological Indicators, 2016, 60: 265–274
[26]Tan X, Xia X, Zhao Q, et al. Temporal variations of benthic diatom community and its main influencing factors in a subtropical river, China. Environmental Science and Pollution Research, 2014, 21(1): 434–444
[27]邵开忠, 吴青文, 刘晓云. 汉江下游江段春季频发“硅藻水华”原因分析. 城市环境, 2002, 16(3): 18–20
[28]Mitrovic S M, Hitchcock J N, Davie A W, et al. Growth responses of Cyclotella meneghiniana (Bacil-lariophyceae) to various temperatures. Journal of Plankton Research, 2010, 32(8): 1217–1221
[29]Mitrovic S M, Chessman B C, Davie A, et al. Development of blooms of Cyclotella meneghiniana and Nitzschia spp . (Bacillariophyceae) in a shallow river and estimation of effective suppression flows. Hydrobiologia, 2008, 596(1): 173–185
[30]Chaffin J D, Mishra S, Kuhaneck R M, et al. Envi-ronmental controls on growth and lipid content for the freshwater diatom, Fragilaria capucina : a candidate for biofuel production. Journal of Applied Phycology, 2012, 24(5): 1045–1051
[31]Hurlbert S H. The nonconcept of species diversity: a critique and alternative parameters. Ecology, 1971, 52(4): 577–586
[32]Potapova M, Charles D F. Distribution of benthic diatoms in US rivers in relation to conductivity and ionic composition. Freshwater Biology, 2003, 48(8): 1311–1328
[33]Stevenson R J, Pan Y, Manoylov K M, et al. Develop- ment of diatom indicators of ecological conditions for streams of the western US. Journal of the North American Benthological Society, 2008, 27(4): 1000–1016
[34]陈峰, 姜悦. 微藻生物技术. 北京: 中国轻工业出版社, 1999: 58–68
[35]刘杨平, 黄迎春, 王鹤立. 浅谈环境因子对硅藻生长的影响. 科技信息, 2009(33): 725
[36]Yao M, Li Y L, Yang X D, et al. Three-year changes in planktonic diatom communities in a eutrophic lake in Nanjing, Jiangsu Province, China. Journal of Freshwater Ecology, 2011, 26(1): 133–141
[37]邢荣莲. 海洋底栖硅藻的筛选, 培养和应用研究[D]. 大连: 大连理工大学, 2007
[38]Wang Q H, Li Y J, Li M. Studies on culture condi- tions of benthic diatoms for feeding abalone. Chinese Journal of Oceanology and Limnology, 1999, 17(2): 105–111
Spatiotemporal Distribution and Its Influence Factors of Diatoms in the Middle and Lower Reaches of Hanjiang River
LIU Qingxiang 1,2 , WANG Ting 1,2 , XU Xuming 1,2 , NI Jinren 1,2,†
1. School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Key Laboratory of Water and Sediment Sciences (MOE), Department of Environmental Engineering, Peking University, Beijing 100871
Abstract To study the temporal and spatial distribution and its influence factors of diatoms in the middle and lower reaches of Hanjiang River, diatom in water and sediment were sampled from 5 monitoring sites in Spring and Fall, 2014. Based on 18S rRNA Illumina Miseq high-throughput sequencing technology, 160 species belonging to 111 genuses, 49 families, 28 orders and 3 classes were identified, of which sediment diatom genuses accounted for 98.6%. The species abundance was higher than that of the previous studies, suggesting the significant advantage of high-throughput sequencing technology in diatom identification. The community composition and dominant species in water and sediment were remarkably different, i.e., Pinnularia , Cyclotella and Nitzschia were the dominant species in water, while the dominant species in sediment were Pinnularia , Nitzschia and Navicula . Meanwhile, there exists obvious difference in temporal and spatial distribution of diatom community, due to the fact that Shannon diversity index displayed apparent spatial heterogeneity and diatom species in sediment were higher than that in water; from the view of season changes, the Shannon diversity index in fall were higher than that in spring. Furthermore, total nitorgen, ammonia nitrogen, nitrate and total phosphorus displayed great impact on diatom community composition. As results, controlling nitrogen and phosphorus concentration in the middle and lower reaches of Hanjiang River will be of great importance to avoid diatom blooms.
Key words high-throughput sequencing; Hanjiang River; diatom; temporal and spatial distribution; environ-mental factor
doi: 10.13209/j.0479-8023.2018.005
中图分类号 X835
收稿日期: 2017-04-22;
修回日期: 2017-05-12;
网络出版日期: 2018-06-27
†通信作者 , E-mail: nijinren@iee.pku.edu.cn
† Corresponding author , E-mail: nijinren@iee.pku.edu.cn
国家自然科学基金(51539001)资助