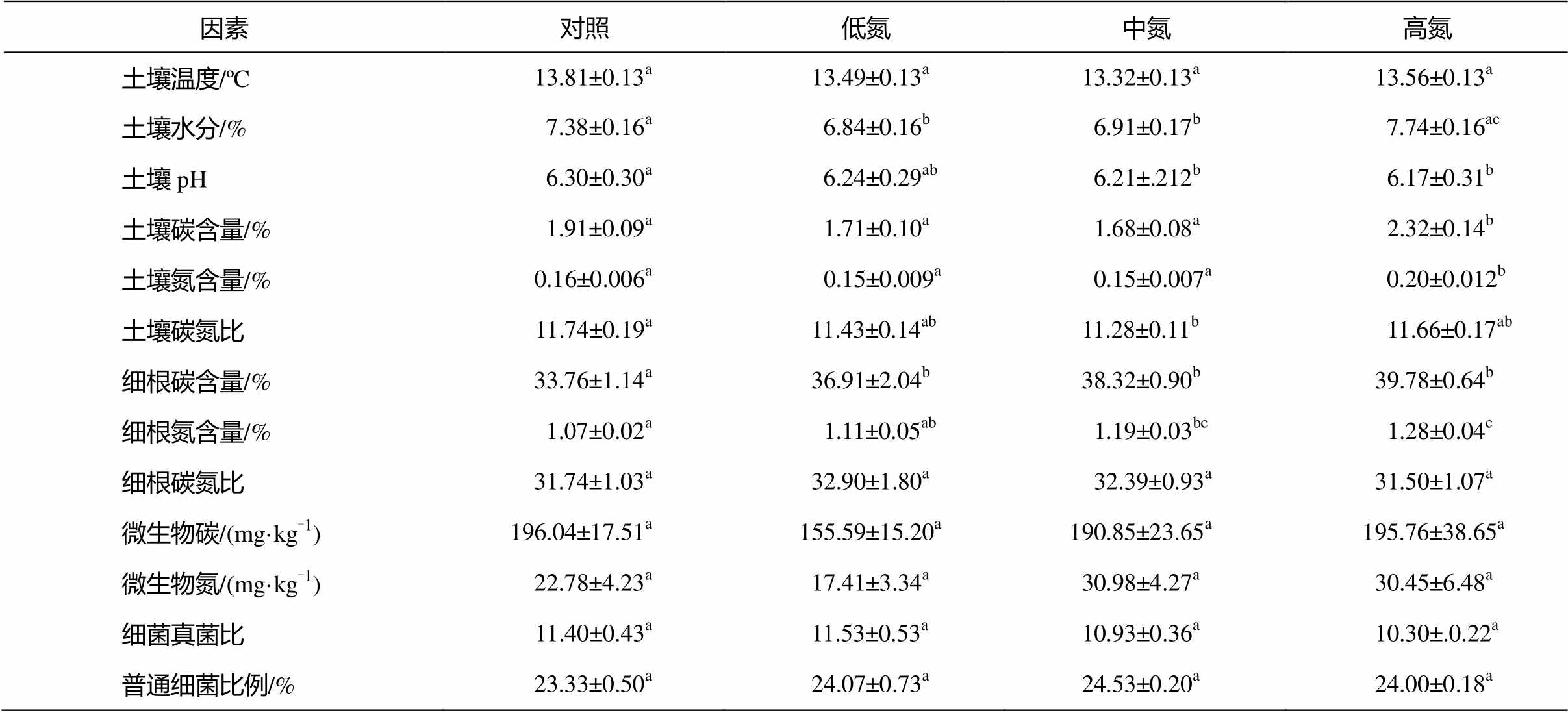
表1 不同浓度氮添加下0~10 cm的生物、非生物因素特性(数据表示为平均值±标准误差)
Table 1 0–10 cm biotic and abiotic properties among four treatments (data is expressed as mean±S.E.)
张江勇 1,2 王娓 1,† 曾辉 1,2
1.北京大学城市与环境学院生态学系, 北京 100871; 2.北京大学深圳研究生院城市规划与设计学院, 深圳 518055;
摘要 在河北塞罕坝樟子松林, 设置对照样方、低氮(20kgN/(hm 2 ·a))、中氮(50kgN/(hm 2 ·a))和高氮(100 kgN/(hm 2 ·a))添加4种处理, 分0~10, 10~20和20~30cm共3个土层, 系统地研究细根生产、周转、碳归还以及细根生产力(NPPfr)占生态系统净初级生产力(NPP)的比例对不同程度氮可获得性的响应, 结论如下: 1)细根生产力在低氮下增大, 高氮下降低; 细根生产力占NPP的比例则相反, 在低氮下降低, 中氮下升高; 2)随氮浓度增大, 细根生物量逐渐降低, 细根周转率增大, 细根碳归还先升(低、中氮)后降(高氮); 3)施氮对细根生产力的影响随土壤深度的加深无显著变化, 施氮对细根周转率的影响在不同深度间则差异显著; 4)结构方程模型表明, 氮添加通过对土壤碳氮含量、pH的影响而改变细根生产力, 通过对细根碳氮含量的影响改变细根周转率。
关键词 细根; 氮浓度; 生产力; 周转率; 土壤深度
细根通常指直径小于2mm的根系, 是根系中最重要、最活跃的部分 [1–2] 。细根从土壤中吸收水分和养分, 并通过自身死亡和分解作用将养分归还给土壤 [2] 。细根生产力是地下生产的最大组分 [3–4] , 占净初级生产力的21%~33% [5] , 细根死亡过程中形成的地下枯落物碳归还可占总枯落物碳输入的6.2%~ 88.7% [6–7] 。因此, 细根生产、周转在碳和养分的分配、循环中有重要作用 [4] 。
到21世纪末, 大气氮沉降会增加2.5倍 [8–9] , 氮肥的施用是20世纪末的两倍 [10] , 因此数十年来广泛的自然或人为氮添加, 对细根生产及其周转的影响不容忽视。然而, 由于测定细根活动难度大, 相对于地上组分, 细根的研究受到很大限制 [11] , 控制细根生产力的因素难以确定 [3] 。关于氮可获得性对细根生产与周转的4种假说(细根生产力和周转率都提高; 细根生产力和周转率都下降; 细根生产力下降, 周转率提高; 细根生产力提高, 周转率下降)仍是争议的热点 [12–13] , 细根生产和周转对氮添加的响应机制尚待研究 [11,14] 。
关于氮添加对根系生产力的影响目前尚无一致的结论。已有研究表明, 随着氮可获得性的增大, 根系生产力或增大 [14–15] , 或降低 [11–12,15–17] , 或不 变 [18] 。氮可获得性对细根生产的影响的Meta分析(410个自然梯度和469个氮添加)结果表明, 细根生产力随氮浓度的增大而增大, 直到土壤氮含量达到0.5%, 随后保持不变或者降低 [14] 。对氮添加下细根生产力占净初级生产力(NPP)的相对比例的研究也无一致结论: 在养分贫瘠的土壤, 虽然细根生产力低, 但是植物可能会分配更多的生产力用于细根生长 [11] ; 氮添加后, 细根生产力增大, 但是占NPP的比例可能降低 [12,14] ; 也有研究表明, 每年施加200 kgN/hm 2 的氮肥, 细根净生产力显著降低, 占总NPP的比例也显著降低 [17] 。综上所述, 细根生产力对氮添加的响应很可能随施氮浓度的不同而不同。
有关氮添加对细根周转率影响的研究表明, 养分充足时, 根系周转快, 相反, 低养分时, 根系的周转慢 [15] ; 氮添加时, 生产力增大, 根系生物量不变或降低, 周转率增大 [14,18] 。相反的研究结果表明, 氮添加下细根生产力降低, 生物量降低, 细根周转率降低或无显著变化 [12] 。有关氮添加对细根生物量影响的研究表明, 细根生物量对营养可获得性变化的响应不同 [19] , 随氮浓度的增大或增大 [15] , 或降低 [11–12,20–21] ; 细根生产与周转的Meta分析表明, 氮沉降总体上显著降低细根生物量(−12.8%), 且在不同梯度的氮添加之间差异较大 [18] , 然而, 该研究中关于氮添加浓度的划分(低(<100kgN/(hm 2 ·a))、中(100~200kgN/(hm 2 ·a))、高(>200kgN/(hm 2 ·a)), 将<100kgN/(hm 2 ·a)全部归纳为低浓度, 实际上此时氮可能已经达到饱和, Li等 [18] 的研究也表明模拟氮沉降的氮添加的数量应少于平均大气氮沉降的两倍。这说明细根从氮限制到氮饱和的变化阈值可能处在低氮水平(大气氮沉降水平)。然而, 细根生产和周转对低氮添加的响应的相关研究较少。
基于上述背景, 我们提出本研究的科学问题: 1)细根生产力和细根生物量对不同浓度氮添加如何响应? 2)细根生产力占总初级生产力(NPP)的比例是否随氮浓度的增大而变化? 3)细根周转率随氮浓度的增大如何变化? 4)氮可获得性通过对何种因素的影响从而导致细根生产与周转的变化? 本研究在河北省赛罕坝樟子松林人工林基地, 设置对照(无N 添加)、低(20 kgN/(hm 2 ·a))、中(50 kgN/(hm 2 ·a))、高(100 kgN/(hm 2 ·a))3 种不同的施氮梯度, 基于内生长法, 测定细根生产力, 同时测定生物因素(土壤微生物碳氮含量、根系碳氮含量、微生物群落结构)和非生物因素(土壤温度、土壤水分、土壤pH、土壤碳氮含量), 系统地研究细根生产、周转对氮可获得性的响应及其机制。因本研究中樟子松林尚处于氮限制状态 [21] , 基于资源最佳分配假说 [11–12,14] 和细根生产力主要受内生因素作用, 细根周转则主要受外生因素影响的研究结果 [11,14] , 提出如下假设: 1)细根生产力和生物量在低氮下升高, 在高氮下降低; 2)细根生产力占NPP的比例在所有氮添加浓度下均降低; 3)细根周转率在低氮下升高, 高氮下降低; 4)不同浓度氮添加通过土壤氮含量影响细根生产力, 通过根系氮含量影响细根周转。
本研究的实验样地位于河北省围场满族–蒙 古族自治县北部的塞罕坝机械林场(42°10′—50′N, 117°12′—30′E)。研究区地处我国暖温带向温带的过渡区域, 同时也是半湿润气候向半干旱气候的过渡区域。由于地势高, 冬季漫长而寒冷, 生长季较短(5—10月), 夏季不明显。当地气象台站40年(1964—2004年)的记录显示, 该地区的年均温为−1.4°C, 1月均温为−12.8°C, 7月均温为14.7°C。年降水量450.1mm, 平均相对湿度为69.5%。土壤类型主要是沙土。本研究选择樟子松人工林作为研究样地, 实验样地中85%的树种为常绿针叶树种樟子松, 15%为落叶松。树龄约为30年, 平均胸径为12.1cm, 平均树高约10.1m, 栽种密度为3500~4000 棵/hm 2 。实验样地林冠层郁闭度较高, 林下阴冷潮湿, 草本层植被稀疏。样地的氮沉降本底值为13.53kgN/(hm 2 ·a), 高于中国氮沉降的平均值(12.89kgN/ (hm 2 ·a)), Du等 [21] 的研究表明, 该樟子松人工林仍然为氮限制的生态系统。
模拟氮沉降样地于 2009 年 5 月布设完成, 采用完全随机法布设样方, 设置 4 种氮添加处理: 对照(无氮添加)、低氮(20kgN/(hm 2 ·a))、中氮(50kgN/(hm 2 ·a))和高氮(100kgN/(hm 2 ·a)), 各 3 个重复, 共 12 个 20m×20m 的完全随机分布的样方, 并在四周以 10 m 的缓冲带作为样方间隔。将尿素溶解于 10 L水中, 使用喷雾器, 在每年的生长季初期进行一次施肥, 对照样方施以 10L水 [21] 。
细根生产力采用内生长法测定 [15] 。在 12 个样地中分别随机选 6 个 1m×1m的小样方, 用土钻分0~10, 10~20 和 20~30cm三层采样, 取出的土壤过2mm 筛, 将其中的石子仍然放回相应层次的土中。将纱袋放入采样洞中, 用 PVC 管捅平纱袋底部, 使其与洞底部及四周密切贴合。将过筛后的土壤按照原来的层次逐层回填, 当土全部回填后系紧袋口, 使纱袋与土壤表面保持水平, 用原来的凋落物覆盖好纱袋上方, 以避免雨水直接冲刷纱袋中的土壤导致纱袋中的土壤低于地表。将电工胶带做的标签露在地表以方便查找纱袋, 用记录笔在标签上编号。72 个纱袋(12 个样地×6 个重复), 每个纱袋分为 0~10, 10~20 和 20~30cm 三层, 共 72×3=216 个样品。依据之前的细根生长预实验, 2013年 7 月将纱袋埋入地下, 1 年后(2014 年 7 月)取出。取出其中的细根, 冲洗烘干称重。研究不同氮浓度对细根生产力(单位为 t/(hm 2 ·a))的影响是否随土壤深度而变化。
细根生物量: 2013 年和 2014 年 8 月, 采用 5.8cm 直径的土钻, 在各样方中随机进行 6 个重复土壤采样(0~30cm), 然后分0~10, 10~20和20~30cm装入自封袋带回实验室。挑出土壤样品中所有直径<2mm的根系物质, 用水洗净, 在70ºC下烘干并称重, 得到细根生物量(单位为t/hm 2 )。
细根周转率=细根生产力/细根生物量 [15] , 单位为%。
细根碳归还=细根生产力×细根碳含量 [6] , 单位为tC/(hm 2 ·a)。
细根生产力、细根生物量、细根周转率和细根碳归还均为2014年数据。
1)土壤温度和水分: 于2013和2014年的7—10月, 采用温度湿度传感器(WET-2 sensor, Delta-T Devices Ltd: Cambridge, UK), 测定不同处理样地土壤温度和水分。
2)根系生物量及碳氮元素含量: 2013 和 2014年的7月, 采用5.8cm直径的土钻, 在样方中随机进行 6 个重复土壤采样(0~30cm), 然后分 0~10, 10~20和20~30cm装入自封袋, 带回实验室。挑出土壤样品中所有的根系物质, 并区分细根(直径<2mm)和粗根(直径>2 mm), 用水洗净, 在70ºC下烘干并称重, 得到细根生物量和粗根生物量。根系物质用植物研磨仪研磨成粉, 采用碳氮元素分析仪(Vario EL III, Elementar, Hanau, Germany)测定。
3)土壤样品的采集: 2014 年 7 月, 采用5.8 cm直径的土钻, 在样方中随机进行 6 个重复土壤采样(0~10cm), 装入自封袋, 带回实验室, 挑出土壤样品中所有的根系物质。将每个土壤样品分为 4 份, 分别用于测定土壤微生物量碳氮、土壤微生物区系组成、pH 和土壤碳氮元素含量。其中土壤微生物量碳氮和土壤微生物区系组成采用鲜土测定, pH和土壤碳氮元素含量采用风干土测定。
4)土壤pH: 土壤样品自然风干后, 除去杂质, 过2mm筛, 以1:5的土水比混合, 用pH计测定土壤的酸碱度(Model PHS-2; 上海仪电科学仪器股份有限公司)。
5)土壤碳氮元素含量的测定: 挑出土壤样品中所有的根系物质, 土壤样品自然风干后过2mm筛, 并用土壤研磨仪研磨成粉, 采用碳氮元素分析仪(Vario EL III, Elementar, Hanau, Germany)测定。
6)土壤微生物量碳氮: 采用氯仿熏蒸法进行微生物生物量碳(microbial biomass carbon, MBC)和生物量氮(microbial biomass nitrogen, MBN)测定。准备两份过筛后的土壤样品, 一份不熏蒸, 另一份用氯仿熏蒸 24 小时, 之后用 0.5mol/L K 2 SO 4 (1:2.5 w / v )进行提取。用重铬酸钾溶液进行滴定, 得到碳的含量, 再用凯氏定氮法得到氮的含量。利用MBC的转换因子 K c =0.38 和 MBN 的转换因子 K n =0.54, 计算得到最终的MBC和MBN [21] 。
7)土壤微生物的区系组成: 通过测定磷脂脂肪酸(phospholipid fatty acid, PLFA)来分析土壤微生物群落的区系组成。操作流程参考文献[22]: 取新鲜土样, 加入磷酸缓冲液, 中速震荡2小时, 离心10分钟, 再加入提取液(CH 3 OH, CHCl 3 与磷酸缓冲液的体积比为2:1:0.8)震荡0.5小时, 再离心10分钟, 分别将所得上层清液、氯仿和磷酸缓冲液倒入分液漏斗, 手动摇晃2分钟, 静置后避光过夜。次日, 用大试管收集下层氯仿相, 37°C水浴氮气吹干, 再用1 mL氯仿分5次溶解转移样品至预先经3 mL氯仿调解的萃取小柱。然后依次分别加入5mL氯仿、10mL丙酮和10 mL甲醇洗提, 小试管收集甲醇相, 37°C水浴氮气吹干。向吹干样品中加入1mL甲醇:甲苯(1:1)和1mL 0.2 mol/L KOH甲醇溶液, 手动摇晃1分钟, 35~36°C水浴15分钟, 迅速加入0.3 mL 1 mol/L甲基化醋酸、2 mL正己烷和2 mL去离子水, 低速震荡10分钟, 用移液枪将上层液体转移至青霉素小瓶, 再加入2mL去离子水, 重复操作一次。氮气吹干小瓶内的萃取液后, 封存于−80°C冰箱备用。上机检测前, 用正己烷溶解备用样品, 以正19烷脂肪酸甲酯(19:0)作为内标, 在气相色谱仪上利用MIDI微生物鉴定系统(MIDI Sherlock Microbial Identification System)进行分析。分析条件如下: 色谱柱为Ultra 2, 炉温260°C, 检测器温度300°C, 进样量为 2 μL, 分流比为1:100, 流速为0.4mL/min, 分析方法为EUKARY。
8)地上凋落物生物量采用凋落物网收集法测定: 于2013和2014年的生长季7—10月, 每月采用 1 m × 1 m的凋落物网收集, 在60°C下烘干称重, 得到地上凋落物生物量。
9)樟子松林生态系统净初级生产力(NPP)测定: 分别于2013和2014年的9月生长季末期, 用胸径尺测定样地内所有树木的胸径( D )、用测高仪测定树高( H ), 采用该研究区域的异速生长方程 [21] : BP (生物量生产)= a ( D 2 H ) b ( R 2 =0.96, p <0.01), a 和 b 为回归常数, a =107.01, b =0.70, 结合Clark等 [23] 关于NPP的计算方法和本研究测定的指标(未测定死根生物量、根系分泌和动物啃食等的生物量), 根据NPP= BP 2014 −BP 2013 +Δaboveground litter (地上凋落物生物量)+Δroot biomass (根系生物量), 得到不同处理下的净初级生产力。
上述生物和非生物因子均为2014年数据。
施氮梯度对0~30 cm细根生产力、细根碳归还、细根生产力占NPP比例等的影响采用单因素方差分析; 细根生产力、生物量和周转率在不同施氮浓度和不同土壤深度间(0~10, 10~20和20~30 cm)的变化采用裂区方差(split-plot ANOVA)分析, 将施氮梯度作为主区因素, 土壤深度作为副区因素。上述分析用SPSS18.0 (IBM SPSS Statistics for Windows, ver.18.0; IBM Corp., Armonk, NY, USA)完成, 其中裂区方差分析在 SPSS 中通过语句编辑实现, 采用SigmaPlot 10.0 软件作图。细根生产力和周转率的影响因素分析采用结构方程模型。统计的显著性水平定义在 p <0.05。
表1 不同浓度氮添加下0~10 cm的生物、非生物因素特性(数据表示为平均值±标准误差)
Table 1 0–10 cm biotic and abiotic properties among four treatments (data is expressed as mean±S.E.)

说明: 同一因素间不同的小写字母代表不同氮浓度间差异显著; 土壤温度和水分为 2013—2014 年生长季(7—10 月)实测温度和水分的均值, 其他因素于2014年7月测定。
氮添加对生物、非生物因素的影响在不同氮浓度间具有较大的差异。对于非生物因素, 低、中氮添加时, 土壤水分显著降低; 随氮浓度的增大, 土壤pH逐渐降低; 土壤碳氮含量在高氮下显著增加, 土壤碳氮比在中氮下显著降低。对于生物因素, 根系碳氮含量在低、中、高氮下均显著增大。土壤温度、微生物碳氮、根系碳氮比、真菌细菌比以及普通细菌的比例随氮可获得性的增大而无显著变化(表1)。
不同浓度氮添加对细根生产力的影响表现为低氮和中氮促进、高氮抑制细根生产力, 其中低氮和高氮间差异显著(图1(a))。细根碳归还随氮浓度的增大呈非线性响应, 在低氮和中氮下升高, 在高氮下降低(图1(b))。
在0~10cm土层, 中氮促进, 低氮和高氮抑制根系生产力; 10~20cm土层, 低氮和中氮促进, 高氮抑制根系生产力; 20~30cm土层, 低氮促进, 中氮和高氮抑制根系生产力, 且低氮与中、高氮梯度间差异显著。与对照细根生产力随深度降低不同, 低氮添加, 细根生产力在20~30cm土层显著增大( p <0.05)。
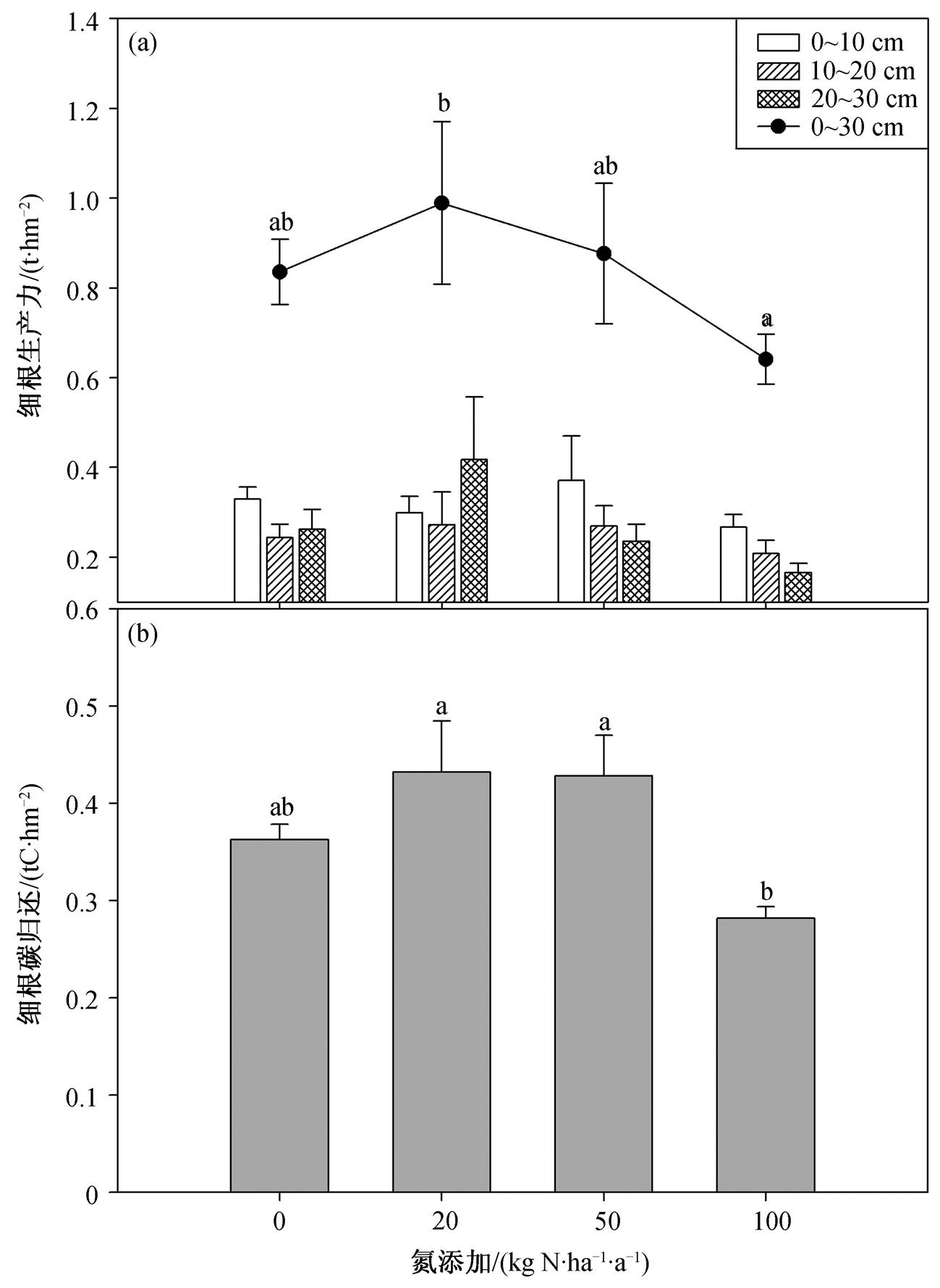
不同的小写字母代表施氮梯度间差异显著; 误差线表示标准误差; 方差分析: 氮浓度 p =0.503, 土壤深度 p =0.250, 氮浓度×土壤深度 p =0.410
图1 不同浓度氮添加的细根生产力(a)和细根生产力碳归还(b)
Fig. 1 Fine root productivity (a) and carbon input of fine root (b)among different treatments
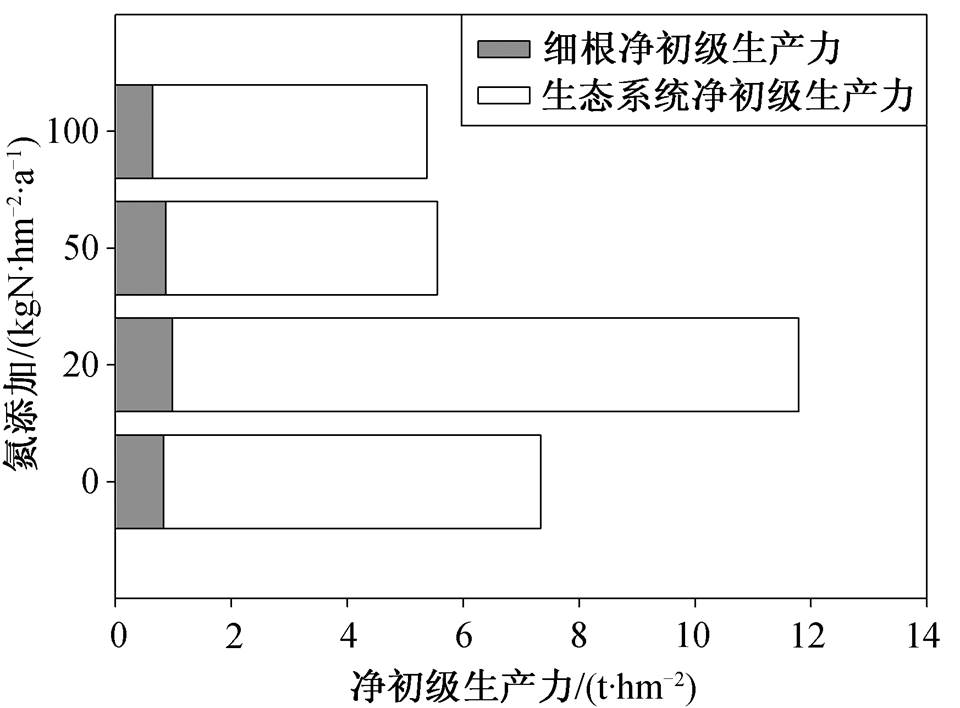
图2 不同浓度氮添加细根生产力相对比例
Fig. 2 Relative proportion of fine root productivity to NPP among different treatments
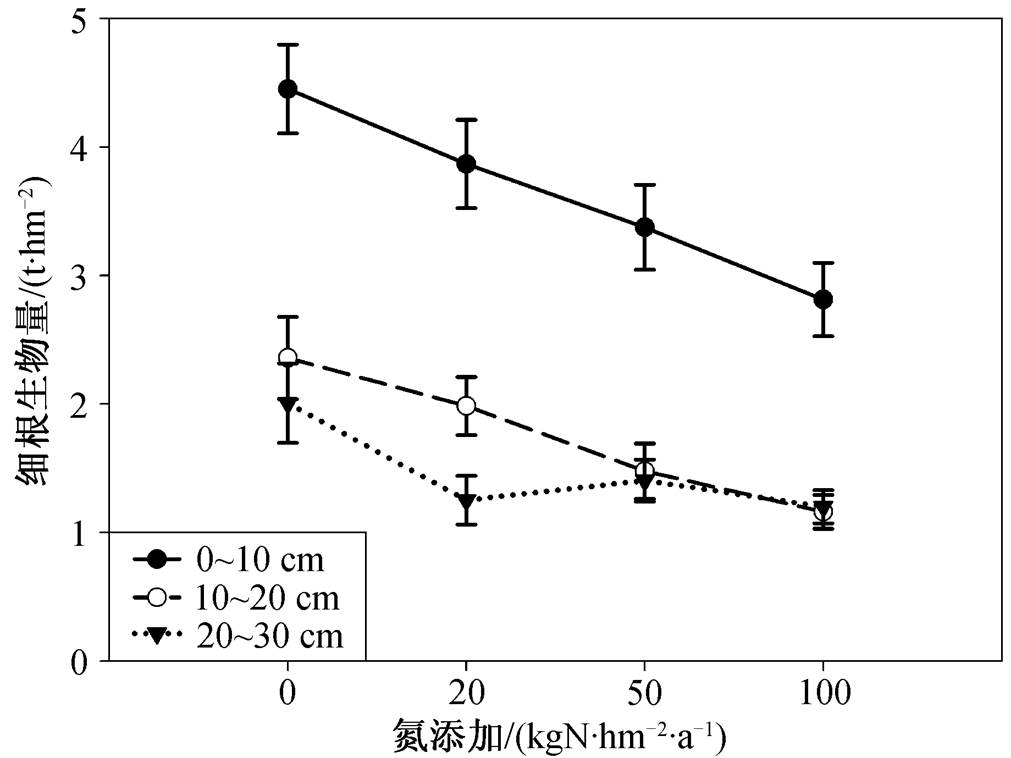
误差线表示标准误差; 方差分析: 氮浓度 p <0.001, 土壤深度 p <0.001, 氮浓度×土壤深度 p =0.497
图3 不同氮浓度添加对细根生物量的影响
Fig. 3 Biomass of fine root among different treatments
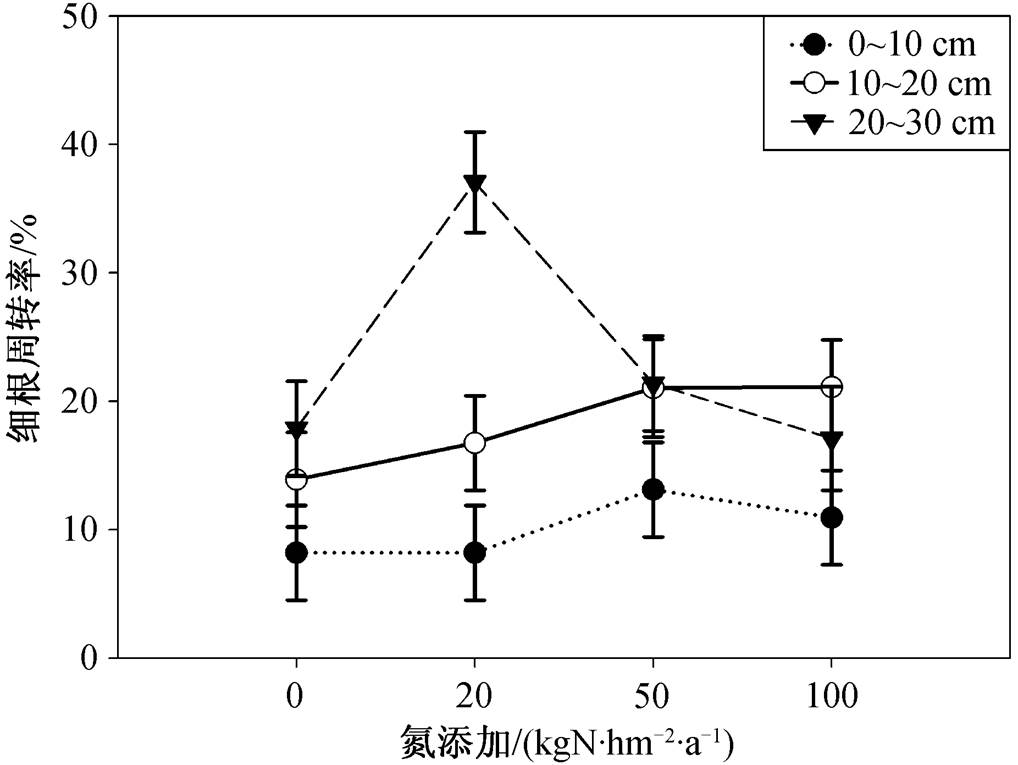
误差线表示标准误差; 方差分析: 氮浓度 p =0.132, 土壤深度 p <0.001, 氮浓度×土壤深度 p =0.011
图4 不同浓度氮添加对细根周转率的影响
Fig. 4 Turnover rate of fine root among different treatments
总体上, 根系生产力在土壤深度间均无显著差异( p =0.250), 施氮梯度与土壤深度两者间无显著的交互作用( p =0.410)(图1(a))。
生态系统净初级生产力(NPP)在对照样方为7.26t/hm 2 , 在低氮下增大至11.94t/hm 2 , 在中氮和高氮下分别降低至5.18和5.86 t/hm 2 。细根生产力占NPP的比例在对照、低氮、中氮和高氮组分别为11.51%, 8.28%, 16.92%和10.93%, 在低氮下降低, 中氮下升高, 高氮下无显著变化, 与氮浓度对细根生产力的影响相反。氮添加对NPP的影响强于对细根生产力的影响, 低氮添加对细根生产力的促进作用小于对NPP的促进作用, 中氮添加对细根生产的抑制弱于对NPP的抑制(图2)。
细根生物量随氮添加浓度的增大而依次显著降低( p <0.001), 随土壤深度的加深而降低( p <0.001), 氮梯度与土壤深度间无显著的交互作用( p =0.497), 细根生物量对氮浓度的响应不随深度而变化(图3)。
由图4可知, 在0~10cm和10~20cm土层, 随氮梯度的增大, 根系周转率增大, 施氮在总体上促进了细根的周转; 在20~30cm土层, 细根周转率随氮浓度的增大呈非线性响应, 在低氮下显著高于对照和中、高氮添加( p <0.05)。总体上, 不同浓度氮添加对细根周转影响的差异在20~30cm土层比浅层土壤(0~20cm)更显著, 土壤深度与施氮梯度间具有显著的交互作用( p =0.011)。
运用结构方程模型, 研究氮可获得性对细根生产与周转的影响机制(图5)。结果表明, 除氮添加直接影响土壤氮的可获得性外, 土壤温度和水分也可间接影响土壤氮的可获得性, 最终导致细根生产与周转在不同浓度氮添加间的差异, 可以解释细根周转率变化的47%, 解释细根生产力变化的44%。
细根生产力的关键影响因素是土壤碳含量, 土壤碳含量对细根生产力的影响具有两面性, 土壤碳含量的增大一方面直接抑制细根生产力, 另一方面, 通过增大细菌真菌比, 间接地促进细根生产力。本研究表明, 低氮和中氮下, 土壤碳含量降低, 而高氮下土壤碳含量升高。然而, 细菌真菌比均随氮添加升高, 且在不同氮浓度间无显著差异(表1)。不同氮浓度对细根生产力的影响, 以土壤碳含量的负向影响为主, 细根生产力呈先促进后抑制的趋势。不同浓度氮添加通过对土壤碳含量的直接影响以及土壤水分对土壤碳含量的间接影响, 最终导致细根生产力的差异。
影响细根周转率变化的关键因素是根系碳含量, 根系碳含量随氮添加浓度的增大而增大(表1), 故周转率随氮浓度的增大而增大。氮添加通过对土壤pH的直接影响以及通过土壤温度、水分对土壤pH的间接影响, 进而显著影响根系碳氮含量, 最终导致不同氮浓度间细根周转率的差异。
本研究表明, 随着氮浓度增大, 细根生产力呈先增后降的趋势, 说明细根生产力对氮可获得性的响应与氮添加的浓度有关。这不同于通常所认识的: 细根生产力的增大, 是为了最大限度地获取有限养分, 故在土壤氮可获得性增大, 养分限制缓解后, 将降低用于细根生产的碳分配 [24] , 也不同于细根生产力与养分可获得性负相关的研究结论 [20] 。
土壤低氮添加增强细根生产力、高氮添加可能会降低细根生产力的推论 [25] , 与本研究结果一致, 高氮导致分配到地上的碳增大, 相反, 在低氮条件下, 光合碳向根系的分配量增大 [25] 。Noguchi等 [26] 的研究表明, 细根生产力对氮添加的响应与土壤本底肥力和氮添加的总量有关, 也说明氮浓度对于细根生产的重要作用。本研究中樟子松林氮的本底值为13.53 kgN/(hm 2 ·a), 与中国氮沉降的平均值(12.89 kgN/(hm 2 ·a))基本上持平, 仍属于轻微氮限制的系统 [21] , 则低氮和中氮添加时, 氮限制缓解, 而高氮添加可能导致氮饱和。前人研究表明, 氮对细根生产力的影响主要通过改变碳源–碳汇关系实现, 氮可获得性的增大会增强光合作用, 从而使得NPP增大 [27] 。为了维持植物生长所需的养分, 根系生产力增大, 以便吸收土壤中的养分。当植物生长到一定程度后, 则通过抑制细根生产来限制养分获取, 以便限制植物生长 [27] 。本研究中, 低氮和中氮添加时NPP和细根生产力增大, 高氮添加时NPP和细根生产力降低的结果, 反向证明了细根生产力随氮添加浓度的增大存在先升后降的趋势, 这与前人关于细根生产力对氮可获得性响应的Meta分析研究结 果 [14] 一致(该Meta分析选取的样本均为采用内生长法测定的样本)。不同的是, 前人研究中, 当土壤氮含量达到0.5%时, 细根生产力由升高转为降低 [14] ; 本研究中, 当土壤氮含量为0.2%(高氮添加)时即下降。这可能是因为本研究样地为干冷型气候, 相对于温度而言, 在北方森林氮沉降已经足够高, 所以与土壤氮含量相比, 高氮添加情况下, 可能温度才是更重要的限制因素 [11] 。本研究中, 细根生产力与温度的相关关系也表明这一点。可见, 氮可获得性程度的不同, 对细根生产力的影响不同, 主要与土壤氮限制的程度以及不同浓度氮添加后土壤氮处于氮限制阶段、氮限制缓解还是氮饱和的阶段有 关 [12,28] 。从总体上看, 细根生产力随氮浓度增大可能会出现先增后降的趋势, 在不同的立地条件下, 由促进到抑制变化的拐点不同; 也可能由于氮沉降的本底值已经较高, 氮添加后细根生产力无增大阶段而直接进入抑制的过程; 或者氮添加后土壤氮仍未达到饱和阶段而产生氮添加对细根生产力的持续促进作用。
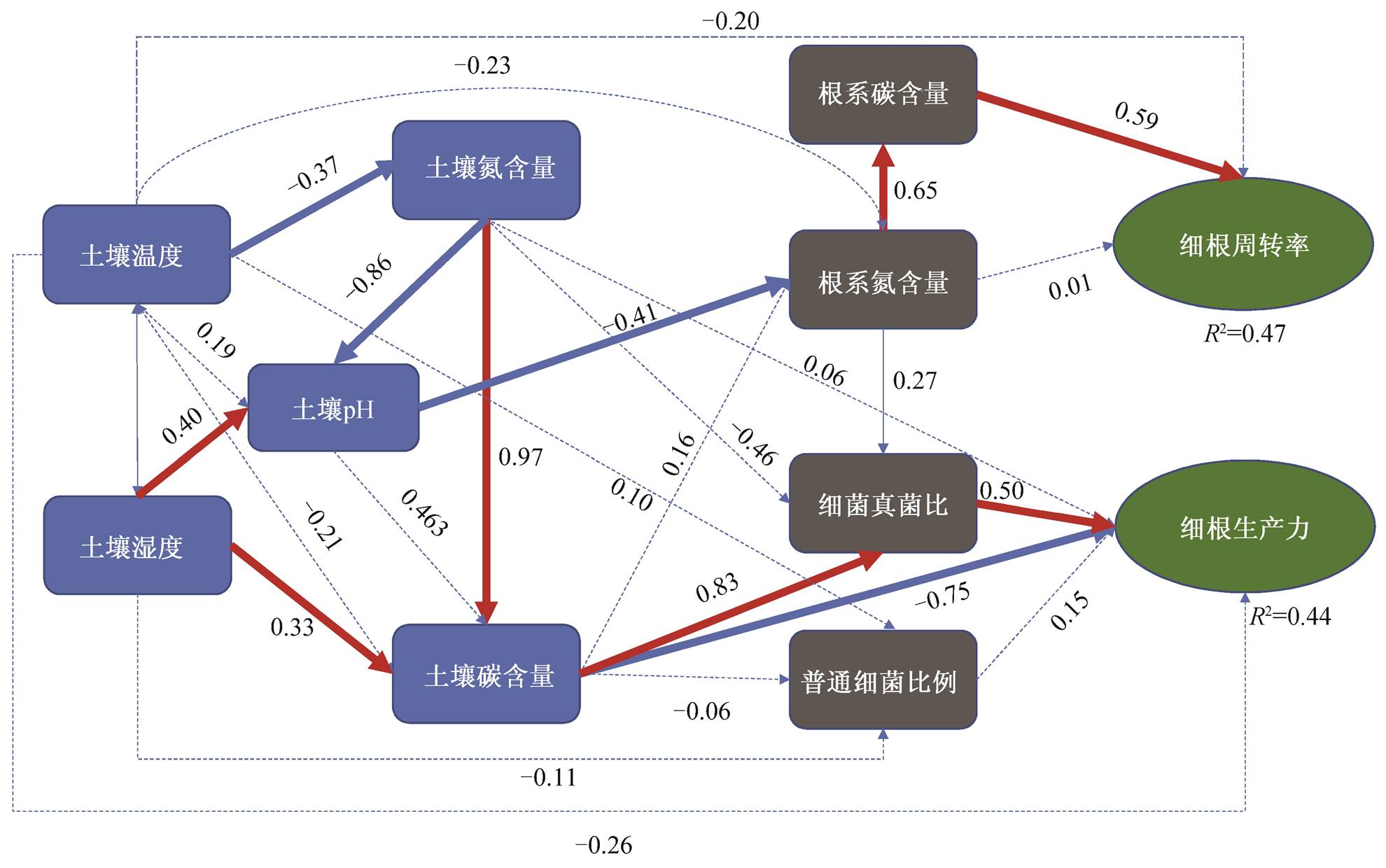
χ 2 =26.676, RMSEA (root mean square error of approximation)=0.001, CFI=1.000, AIC (Akaike information criteria)=102.676, p =0.536, 样本量 n =72。红色实线表示显著的正影响( p <0.05), 蓝色实线表示显著的负影响( p <0.05), 虚线表示未达到显著水平; R 2 表示回归拟合优度, 线上标注的数字表示标准化回归系数
图5 氮添加对细根生产与周转影响的结构方程模型
Fig. 5 A structural equation model of N-addition effects on fine root productivity and turnover
本研究中细根生产力占生态系统NPP的比例, 在低氮下降低, 在中氮下升高, 低氮的研究结果与前人一致, 中氮的结果则不甚相同。前人研究表明, 在氮限制的土壤, 虽然细根生产力低, 但植物可能会分配更大比例的生产力用于细根生长 [11,29] 。Meta分析表明, 当氮可获得性增大时, 细根生产力增大, 但增幅低于地上净初级生产力(ANPP), 因此细根生产力占NPP的比例降低 [12,14] , 符合本研究低氮添加的结果。本研究的中氮添加情况下, 细根生产力降低而占NPP的比例升高, 不同于前人的氮添加(200 kgN/hm 2 )研究结果: 细根净生产力显著降低, 占NPP的比例也从对照样方的46%降低至23% [17] 。这可能是因为氮添加对根系生产力的影响大于对地上部分的影响(表现为低氮对地上生产力的促进大于对根系生产力的促进, 而中氮对地上生产力的抑制强于对根系生产力的抑制)(图3)。前人的研究也表明, 与根系相比, 地上部分对模拟氮沉降更敏 感 [18] 。这说明, 不同浓度的氮添加通过对细根生产力以及生态系统NPP的影响, 来共同决定细根生产力的分配比例。中氮添加情况下, 光合碳对细根生产力分配的比例虽然增大, 但也不违背最佳分配假说 [24,30–31] (该假说认为氮可获得性增大时, 植物将降低用于获取养分的碳分配, 从而向地下生产力的分配降低), 因为如果生态系统受到其他养分或水分的约束, 也会增加向根系的碳分配 [24,32] 。本研究的中、高氮添加, 可能导致土壤中其他养分(如磷)的限制 [18,33] , 或者是水分的限制 [22,34–35] , 从而对细根生产力分配的比例反而增大。前人研究表明, 细根生产力对资源可获得性的响应分为对某一限制性养分的响应和对多种养分可获得性的交互响应 [25] , 也说明氮限制的缓解与其他养分的限制对根系碳分配的影响。
此外, 本研究结果表明, 细根生产力对氮可获得性的响应在不同深度间无显著差异, 这与细根生产力随土壤深度加深而降低的Meta分析结果不同 [11] 。前人研究表明, 表层土壤是提供根系热量、水分和养分的主要场所 [2,36] , 土壤深层养分含量降低会影响根系在深层的分布 [1] , 且随着土壤深度的增加, 土壤紧实度逐渐增大, 通透性变差, 对细根生长不利 [36–37] 。Yang等 [38] 认为表层根系对养分获取和碳循环的作用大, 深层根系对水分的获取具有重要作用。本研究区降水丰富, 蒸发量低, 并非水分限制的区域, 氮添加后, 养分的渗漏缓解了深层土壤养分的限制。前人关于氮添加对细根生产力影响的研究也表明, 深层土壤的氮可获得性增大最显著 [27] , 细根生产力对氮添加的响应在0~30cm的范围内随深度的加深无显著变化。前人的研究表明, 氮添加为60kgN/(hm 2 ·a)的情况下, 细根生产力增大, 且不随深度而显著变化 [27] , 与本研究结果相似; 不同的是, 该研究为单一梯度的氮添加研究, 本研究则表明, 不同浓度的氮添加对细根生产力的影响均不随土壤深度而变化。
关于氮可获得性通过何种机制影响细根生产力, 前人的研究发现, 氮可获得性不直接影响细根生产与死亡, 而是通过对根系的间接影响来改变细根生产力 [27] , 这与本研究结果一致。不同的是, 已有研究认为水分和根系氮含量是细根生产最重要的影响因素 [25] , 本研究的结构方程模型则表明, 氮可获得性通过影响pH、土壤碳氮含量等, 间接地影响细根生产力, 细根生产主要是受到土壤碳氮含量的影响, 而不是根系碳氮含量的影响, 且土壤水分是氮可利用性的重要影响因素 [25] , 土壤水分也是通过影响土壤碳含量而间接地影响细根生产。此外, 虽然也有研究表明细根生产力与土壤碳含量的关系密切, 但不同的是, 前人认为土壤碳含量越高, 细根生产力越大 [39] , 而本研究表明, 细根生产力受到土壤碳含量的双重影响: 土壤碳含量的增大, 一方面直接抑制细根生产力, 另一方面通过促进细根真菌比, 间接地促进细根生产力。在低氮和中氮条件下, 土壤碳含量降低, 而高氮条件下土壤碳含量升高。然而, 细菌真菌数量比随氮添加升高, 且在不同氮浓度间无显著差异, 因此氮浓度对细根生产力的影响, 以土壤碳含量的直接抑制作用为主。不同于光、温度、水分限制对细根生产力的影响大于氮添加影响的研究结论 [29] , 本研究表明, 氮可获得性对细根生产有重要影响, 还表明土壤温度、水分也通过对土壤碳氮含量、土壤pH等的影响而造成不同浓度氮添加间细根生产力的差异。
本研究结果表明, 在0~10和10~20cm土层, 细根周转率随氮浓度的增大而增大, 这与Li等 [18] 关于氮可获得性对细根周转影响的Meta分析结果一致。
本研究中0~10cm细根氮含量随氮添加浓度的增大而增大(表1), 结合结构方程模型可知, 氮添加通过影响土壤氮含量和pH, 间接地导致根系氮、碳含量增大, 进而导致细根周转率增大。这是因为根系氮含量的增大会促进细根呼吸 [40] , 为了降低呼吸的消耗, 植物可能通过缩短细根寿命来保证吸收效率和降低呼吸消耗, 促使周转加快 [13] 。此外, Smithwick等 [32] 认为, 根据投资–收益原则, 当植物在模拟氮沉降下达到氮饱和时, 维持细根寿命的收益大于细根吸收更多的氮带来的收益, 因此细根寿命延长。从本研究的树种来看, 樟子松林是与菌根真菌密切结合的树种 [21–22] , 研究表明, 细根受共生真菌侵染后寿命延长, 而氮有效性的提高可能降低共生真菌的侵染率 [41] , 导致寿命缩短, 周转加快。
氮添加浓度不仅影响细根周转率, 而且影响其随土壤深度的变化趋势。这与前人关于氮添加降低周转速率, 氮添加与土壤深度对细根周转的影响无显著的交互作用的研究结果 [27] 相反。可能因为前人研究中只是单一浓度氮添加(60kgN/(hm 2 ·a))有 关, 本研究低氮(20kgN/(hm 2 ·a))和中氮(50kgN/ (hm 2 ·a))对细根周转的影响不随深度变化, 高氮 (100kgN/(hm 2 ·a))对细根周转的影响随深度而变化, 说明氮添加对细根周转的影响是否随土壤深度变化, 与氮浓度密切相关。与0~10和10~20cm土层细根周转率随氮浓度的增大而增大不同的是, 20~30cm土层细根周转率随氮添加浓度的变化呈现先增后降的趋势。研究表明, 氮添加后, 深层土壤氮可获得性的变化最显著 [27] , 从而导致细根周转率随氮浓度增大的变化在20~30cm土层最显著, 在低浓度氮添加时显著增大, 而在高浓度氮添加时降低。此外, 虽然氮添加总体上促进细根周转, 但是随着氮添加浓度的增大, 单位土壤氮含量的增大对细根周转的促进作用降低, 甚至高氮对20~30cm土层的细根周转呈现一定的抑制作用。Kern等 [42] 发现, 50kgN/hm 2 的氮添加导致细根的周转率加快, 而在100和200kgN/hm 2 的氮添加情况下, 细根周转率不再变化。这与本研究的结果相似, 均表明随氮添加浓度的增大, 细根周转率可能会呈先升后降的响应趋势。
根据结构方程模型可知, 氮添加对细根周转率的影响主要通过促进根系碳氮含量增加而造成, 这不同于土壤温度、土壤水分等对细根周转影响更大的研究结论 [43] , 也不同于土壤温度和水分直接作用于细根周转的研究结论 [27] 。本研究结果表明, 在氮添加情况下, 细根氮碳含量的变化是影响细根周转率的更重要的因素, 由表1可知, 细根碳氮含量随氮添加浓度的增大而逐渐升高, 细根周转率也随氮浓度增大而增大。土壤温度、土壤水分对细根周转的影响也是通过对土壤碳氮含量的影响而实现; 土壤温度通过对土壤氮可获得性和pH的影响, 导致细根周转加快; 土壤含水量在低、中氮添加情况下显著降低(表1), 间接地导致细根周转率增大。
本研究基于在塞罕坝樟子松林的氮添加实验, 研究低氮(20 kgN/hm 2 )、中氮(50 kgN/hm 2 )和高氮(100 kgN/hm 2 )3种浓度氮添加对细根生产力、生物量和周转率的影响及其在不同土壤深度(0~10, 10~ 20和20~30 cm)之间的差异, 得出如下结论。
1)细根生产力随氮添加浓度的增大先增后降, 且氮添加浓度对细根生产力的影响不随土壤深度而变化。
2) 细根生产力占净初级生产力的比例在低氮和中氮添加时降低, 在高氮添加时升高。
3)在0~10和10~20 cm土层, 细根周转率随氮添加浓度的增加而增大; 在20~30cm土层, 细根周转率随氮浓度的增加先增后降。氮浓度对细根周转率的影响在不同土壤深度间差异显著。
4)细根生产力与土壤碳氮含量密切相关, 细根周转率则与根系碳氮含量显著相关。氮添加通过影响土壤氮含量和根系氮含量, 间接地改变土壤pH、土壤碳含量和根系碳含量, 结合土壤温度和水分对土壤碳氮含量的影响, 共同导致不同浓度氮添加间细根生产力与周转率的差异。
参考文献
[1]王永吉, 赵学春, 来利明, 等. 三工河流域梭梭群落细根生长动态及周转. 生态与农村环境学报, 2013, 29(5): 666–670
[2]陈莉莉, 袁志友, 穆兴民, 等. 森林细根生产力研究进展. 西北林学院学报, 2015, 30(3): 70–75
[3]Nadelhoffer K J, Raich J W. Fine root production estimates and belowground carbon allocation in forest ecosystems. Ecology, 1992, 73(4): 1139–1147
[4]Addo-Danso S D, Prescott C E, Smith A R. Methods for estimating root biomass and production in forest and woodland ecosystem carbon studies: a review. Forest Ecology and Management, 2016, 359: 332–351
[5]陈光水. 杉木林年龄序列土壤呼吸与地下碳分配[D]. 福州: 福建师范大学, 2009
[6]陈光水, 杨玉盛, 钱伟, 等. 格氏栲和杉木人工林地下碳分配. 生态学报, 2005, 25(11): 2824–2828
[7]Chen G S, He Z M, Xie J S, et a1. Comparatively study on fine root production, distribution and turnoverbetween plantations of Fokienia hodginsii and Cun- ninghamia lanceolate. Scientia Silvae Sinicae, 2004, 40(4): 15–21
[8]Lamarque J F, Kiehl J T, Brasseur G P, et a1. Assessing future nitrogen deposition and carbon cycle feedback using a multimodel approach: analysis of nitrogen deposition. Journal of Geophysical Research Atmospheres, 2005, 110(19): 2657–2677
[9]Vallack H W, Leronni V, Metcalfe D B, et a1. Applica- tion of nitrogen fertilizer to a boreal pine forest has a negative impact on the respiration of ectomycorrhizal hyphae. Plant Soil, 2012, 352(1/2): 405–417
[10]Chen D M, Lan Z C, Hu S J, et a1. Effects of nitrogen enrichment on belowground communities in grassland: relative role of soil nitrogen availability vs soil acidification. Soil Biology and Biochemistry, 2015, 89: 99–108
[11]Yuan Z Y, Chen Han Y H. Fine root biomass, pro- duction, turnover rates, and nutrient contents in boreal forest ecosystems in relation to species, climate, fertility, and stand age: literature review and meta-analyses. Critical Reviews in Plant Sciences, 2010, 29(4): 204–221
[12]Nadelhoffer K J. The potential effects of nitrogen deposition on fine-root production in forest ecosys- tems. New Phytologist, 2000, 147(1): 131–139
[13]郭大立, 范萍萍. 关于氮有效性影响细根生产量和周转率的四个假说. 应用生态学报, 2007, 18(10): 2354–2360
[14]Yuan Z Y, Chen H Y H. A global analysis of fine root production as affected by soil nitrogen and phosphor-rus. Proceedings of the Royal Society B: Biological Sciences, 2012, 279: 3796–3802
[15]Cormier N, Twilley R R, Ewel K C. Fine root productivity varies along nitrogen and phosphorus gradients in high-rainfall mangrove forests of Micro-nesia. Hydrobiologia, 2015, 750(1): 69–87
[16]Haynes B E, Gower S T. Belowground carbon alloca-tion in unfertilized and fertilized red pine plantations in northern Wisconsin. Tree Physiology, 1995, 15(5): 317–325
[17]Gower S T, Vogt K A, Grier C C. Carbon dynamics of Rocky Mountain Douglas-fir: influence of water and nutrient availability. Ecological Monographs, 1992, 62 (1): 43–65
[18]Li W B, Jin C J, Guan D X, et al. The effects of simulated nitrogen deposition on plant root traits: a meta-analysis. Soil Biology and Biochemistry, 2015, 82: 112–118
[19]Varik M, Aosaar J, Ostonen I, et al. Carbon and nitro- gen accumulation in belowground tree biomass in a chronosequence of silver birch stands. Forest Ecology and Management, 2013, 302(6): 62–70
[20]Hendricks J J, Hendrick R L, Wilson C A, et al. Assessing the patterns and controls of fine root dy- namics: an empirical test and methodological review. Journal of Ecology, 2006, 94(1): 40–57
[21]Du Z H, Wang W, Zeng W J, et al. Nitrogen depositionenhances carbon sequestration by plantations in Nor- thern China. PLoS ONE, 2014, 9(2): 1–9
[22]Bossio D, Scow K. Impacts of carbon and flooding on soil microbial communities, phospholipid fatty acid profiles and substrate utilization patterns. Microbial Ecology, 1998, 35(3): 265–278
[23]Clark D A, Brown S, Kicklighter D W, et al. Measu- ring net primary production in forests, concepts and field methods. Ecological Applications, 2001, 11(2): 356–370
[24]Ostonen I, Lõhmus K, Helmisaari H, et al. Fine root morphological adaptations in Scots pine, Norway spruce and silver birch along a latitudinal gradient in boreal forests. Tree Physiology, 2007, 27(11): 16–27
[25]Block R M A, Van Rees K C J, Knight J D. A review of fine root dynamics in Populus plantations. Agro- forestry Systems, 2006, 67(1): 73–84
[26]Noguchi K, Nagakura J, Konôpka B, et al. Fine-root dynamics in sugi ( Cryptomeria japonica ) under mani- pulated soil nitrogen conditions. Plant Soil, 2013, 364(1/2): 159–169
[27]Artacho P, Bonomelli C. Changes in fine-root produc- tion, phenology and spatial distribution in response to N application in irrigated sweet cherry trees. Tree Physiology, 2016, 36(5): 601–617
[28]Vourlitis G L, Hentz C S. Impacts of chronic N input on the carbon and nitrogen storage of a postfire mediterranean-type shrubland. Journal of Geophysical Research: Biogeosciences, 2016, 121(2): 385–398
[29]Rytter R M. The effect of limited availability of N or water on C allocation to fine roots and annual fine root turnover in Alnus incana and Salix viminalis . Tree Physiology, 2013, 33(9): 924–939
[30]Yang Y H, Fang J Y, Ma W H, et al. Large-scale pat-tern of biomass partitioning across China’s grasslands. Global Ecology and Biogeography, 2010, 19(2): 268–277
[31]Martinez C, Alberti G, Cotrufo M F. Belowground carbon allocation patterns as determined by the in-growth soil core 13 C technique across different eco- system types. Geoderma, 2016, 263: 140–150
[32]Smithwick E A H, Eissenstat D M, Lovett G M, et al. Root stress and nitrogen deposition: consequences and research priorities. New Phytologist, 2013, 197 (3): 712–719
[33]Vitousek P M, Porder S, Houlton B Z, et al. Terres-trial phosphorus limitation: mechanisms, implications, and nitrogen-phosphorus interactions. Ecological App- lications, 2010, 20(1): 5–15
[34]Quan X K, Wang C K, Zhang Q Z, et al. Dynamics of fine roots in five Chinese temperate forests. Journal of Plant Research. 2010, 123(4): 497–507
[35]Poorter H, Niklas K J, Reich P B, et al. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control. New Phytologist, 2012, 193(1): 30–50
[36]张良德, 徐学选, 胡伟, 等. 黄土丘陵区燕沟流域人工刺槐林的细根空间分布特征. 林业科学, 2011, 47(11): 31–36
[37]Lawrence D J, Luckai N, Meyer W L, et a1. Distri- bution of white spruce lateral fine roots as affected by the presence of trembling aspen: root mapping using simple sequence repeat DNA Profiling. Canadian Journal of Forest Research: Revue Canadienne de Recherche Forestiere, 2012, 42(8): 1566–1576
[38]Yang Y S, Chen G S, Lin P, et a1. Fine root distribu-tion, seasonal pattern and production in four plantations compared with a natural forest in subtropical China. Annals of Forest Science, 2004, 61(7): 617–627
[39]Xiong Y M, Liu X, Guan W, et al. Fine root functional group based estimates of fine root production and turnover rate in natural mangrove forests. Plant Soil, 2017, 413: 83–95
[40]Burton A J, Pregitzer K S, Ruess R W, et al. Root respiration in North American forests: Effects of nitrogen concentration and temperature across biomes. Oecologia, 2002, 131(4): 559–568
[41]King J S, Albaugh T J, Allen H L, et al. Belowground carbon input to soil is controlled bynutrient availa- bility and fine root dynamics in loblolly pine. New Phytologist, 2002, 154(2): 389–398
[42]Kern C C, Friend A L, Johnson J M F, et al. Fine root dynamics in a developing Populus deltoides plantation. Tree Physiology, 2004, 24(6): 651–660
[43]Larreguy C, Carrera A L, Bertiller M B. Production and turnover rates of shallow fine roots in rangelands of the Patagonian Monte, Argentina. Ecological Re- search, 2012, 27(1): 61–68
Fine Root Productivity and Turnover Rate Respond Nonlinearly to Increased Nitrogen Availability
ZHANG Jiangyong 1,2 , WANG Wei 1,† , ZENG Hui 1,2
1.Department of Ecology, College of Urban and Environment, Peking University, Beijing 100871; 2.School of Urban Planning and Design, Peking University Shenzhen Graduate School, Shenzhen 518055
Abstract A N addition experiment was established with four treatments: control (no fertilization), low-N (20 kgN/(hm 2 ·a)), medium-N (50 kgN/(hm 2 ·a)) and high-N fertilization (100 kgN/(hm 2 ·a)) in an N-limited Pinus sylvestris forest in Hebei Province, North China to study the production, biomass and turnover of fine root systematically. The results showed that fine root productivity (NPPfr) increased in low-N plots, decreased in high-N treatment, while the proportion of NPPfr to net primary productivity (NPP) reduced in low-N addition and increased in medium-N addition. With the increase of N availability, root biomass decreased, turnover rate increased, and carbon returned to soil decreased at first and increased later. The influence of N availability on NPPfr didn’t change with depth, while turnover rate varied among depth. N-addition made an impact on fine root productivity through soil nitrogen content, soil carbon content and soil pH, while affecting turnover rate of fine root by root carbon and nitrogen content.
Key words fine root; nitrogen concentration; productivity; turnover rate; soil depth
doi: 10.13209/j.0479-8023.2018.002
中图分类号 Q948
收稿日期: 2017−04−11;
修回日期: 2017−05−14;
网络出版日期: 2018−06−27
†通信作者 , E-mail: wangw@urban.pku.edu.cn
†Corresponding author , E-mail: wangw@urban.pku.edu.cn