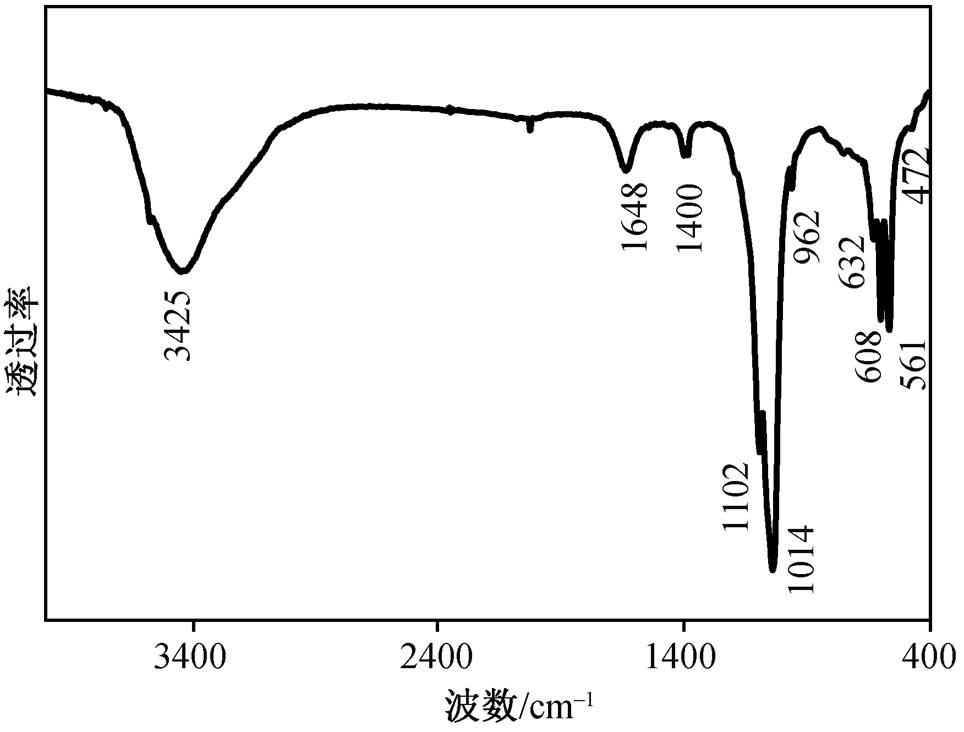
图1 TiHAP的红外光谱
Fig. 1 FTIR spectrum of TiHAP
鞠传伦 1,2 张健伟 1,2 孙卫玲 1,2,† 若村正人 3 塚田峰春 3 佐佐正名 4
1. 深圳市重金属污染控制与资源化重点实验室, 北京大学深圳研究生院环境与能源学院, 深圳 518055; 2. 水沙科学教育部重点实验室, 北京大学环境科学与工程学院, 北京 100871; 3. 富士通研究所环境能源研究中心, 日本神奈川县厚木市 243-0000; 4. 富士通研究开发中心有限公司, 北京 100025
摘要 以 17α-乙炔雌二醇(EE2)为目标污染物, 以载钛羟基磷灰石(TiHAP)为催化剂, 对比研究 TiHAP 和TiO 2 对 EE2 的光催化规律、影响因素及机理, 分析光催化降解的中间产物及降解途径。实验结果表明, TiHAP 薄膜对 EE2 的降解速率高于 TiO 2 薄膜; 随着 Fe 3+ 浓度增加, TiHAP降解 EE2 的速率没有明显变化, TiO 2 降解 EE2 的速率则先增加后减小; 随着富里酸(FA)浓度的增加, TiHAP 降解 EE2 的速率减小, 而 TiO 2 降解 EE2 的速率升高。用 LC-MS n 对 TiHAP 光催化降解 EE2 过程中产生的中间产物进行分析, 在中性pH条件下共确定 9 种降解产物, 比同样 pH 值下以 TiO 2 为催化剂检出的产物种类多, 推断其降解的主要途径是苯环羟基化、开环羧基化以及脱羧等一系列反应。
关键词 载钛羟基磷灰石; 17α-乙炔雌二醇; 光催化降解
类固醇是内分泌干扰物中的一大类物质, 在自然界普遍存在, 其潜在的危害性较大, 在ng/L浓度水平就可引起水生生物雌性化, 人类诸多的疾病与类固醇物质有密切关系 [1] 。17α-乙炔雌二醇(EE2)是一种人工合成的类固醇, 是口服避孕药的主要成分, 是活性最强的环境内分泌干扰物之一, 其活性大于雌二醇(E2) [2] 。研究表明, 在浓度小于 1.0ng/L 时, EE2 就能导致鱼类体内产生卵黄蛋白原, 浓度为 4.0ng/L 时, 可导致幼鱼性畸形, 从而改变其第二性 征 [3–4] 。污水处理厂出水口附近水域中含有的 EE2, E2 和雌酮(E1)可以导致野生雄性鱼类产生雌性化现象 [5–6] 。水体中存在的低浓度EE2 也会对胎儿性别产生影响, 并引发生殖器官的癌变, 改变葡萄糖和脂肪的代谢能力 [7–8] 。
目前, 去除 EE2 的主要方法包括吸附法 [9–11] 、微生物降解 [12–14] 和高级氧化法 [15–17] 等。在众多去除EE2的方法中, 光催化方法以其在室温下深度反应, 并且能直接利用光能作为反应驱动力等独特的性能, 成为一种理想的环境污染治理新技术 [18] 。已有的利用光催化氧化技术对EE2降解的研究, 主要针对不同催化剂及催化条件下 EE2 的降解效果和速率。人工合成的纳米羟基磷灰石(HAP)粉体, 由于具有较高的比表面积和良好的吸附性能而作为一种新型、环境友好且高效的吸附剂, 广泛应用于有机污染物与重金属共存废水的吸附分离等领域 [19–20] 。HAP 中的 Ca 2+ 离子在水介质中能与若干金属离子发生交换, 为有特殊性能的离子进入晶体结构, 改善 HAP 性能提供了可能性。例如, 将 Ag + , Cu 2+ 和 Ti 4+ 等固溶在 HAP 中得到复合材料, 作为杀菌剂使用; 在光照条件下, 用含 Ti 的HAP 催化降解氮氧化物、醛类等有机污染物和酸性媒介红、亚甲基蓝等染料。由于能提供晶格氧, 羟基磷灰石可以作为氧化剂, 但是催化活性不强, 在负载金属催化剂 Ti 后, 其活性明显提高 [21] 。Wakamura 等 [22] 的研究表明, HAP 在掺杂低浓度的Ti元素时, Ti可以与Ca进行1:1置换, 在晶体内和晶体表面以[Ti(OH) 2 ] 2+ 或 [TiHPO 4 ] 2+ 形式存在, 因此能够像 TiO 2 一样在紫外光照射下产生电子和空穴对, 并且相对于 TiO 2 能够展现出更好的吸附及光催化性能。Nishikawa [23] 将 TiO 2 负载在活性羟基磷灰石的表面, 在紫外光(254 nm)照射条件下, 使乙醛通过复合薄膜表面产生 CO 2 , 20 分钟内 CO 2 的产生量即能达到最大值。由于羟基磷灰石和 TiO 2 的共同作用, 使得催化降解的去除率显著提高。Li 等 [24] 研究钛取代羟基磷灰石对双酚 A (BPA)的降解, 发现 TiHAP 和 TiO 2 粉体对 BPA 的吸附符合 Langmuir 吸附等温方程, 且前者吸附性能更好, TiHAP 薄膜光催化降解 BPA 的性能优于 TiO 2 薄膜。
本研究以 EE2 为目标污染物, 以载钛羟基磷灰石(TiHAP)为催化剂, 研究 TiHAP 光催化降解 EE2的降解规律、影响因素及其机理, 并与 TiO 2 进行对比, 着重分析光催化降解过程中的中间产物, 通过对降解中间产物的结构分析, 推断 TiHAP 光催化降解EE2的反应机理和降解途径。
实验试剂: TiHAP (由日本富士通研究所环境能源研究中心提供), 甲醇(HPLC 级, 比利时 J&K Chemical 公司), 17 α -乙炔基雌二醇(纯度>98%, 美国 Sigma 公司), 实验中所使用的其他试剂均为分 析纯。
实验仪器: 液质联用仪(HP 1100 LC-MS n Trap SL System, 美国安捷伦公司), 超纯水仪(MILLI-Q GRADIENT SYSTEM, 美国MILLIPORE公司)。
1.2.1 催化剂表征
样品与溴化钾 KBr(光谱纯)在 75ºC 下干燥 24小时。将少量样品与 KBr 混合(1:100), 用玛瑙研钵研磨后压制成片。用傅立叶变换红外光谱分析仪(FTIR, Tensor27, 德国 Bruker 公司)测定样品的红外光谱。选择波数范围为 4000~400cm −1 , 分辨率为 1cm −1 。预先测定 KBr 在相应波数范围内的光谱, 作为空白对照实验, 将所测得的样品谱图用KBr 谱图校正后进行差减处理, 得到样品的实际红外谱图。
利用氮气和水蒸气的吸附与脱附曲线来确定实验所用TiHAP与TiO 2 的比表面积, 同时还可测出样品的孔径。采用比表面积(BET)方法计算得到两种颗粒的比表面积。气体的相对压力 P / P 0 为 0.00~ 0.45, 计算时在此范围内选择数据点。用 BJH 方法计算得到孔径分布曲线, 饱和蒸汽压 P / P 0 为 0.05~ 1.0, 利用脱附数据进行计算, 在 P / P 0 =0.989 时的计算值为总孔容。所测样品的脱气时间为 16 小时, 脱气的温度为300ºC。
1.2.2 光催化实验方法
为了更加接近实际应用条件, 光催化降解 EE2的动力学研究采用膜实验的方法, 即将催化剂制成薄膜状。由于粉体在实际应用中难以回收, 因此催化剂粉体多用于实验研究, 在实际工程中通常将催化剂制成薄膜状。用直径为 9cm 的结晶皿, 分别称取 2gTiHAP 和 TiO 2 粉末, 用大约 10mL 超纯水分散, 将粉末完全混匀后置于 98ºC 的烘箱中干燥约 1 小时, 直至水分完全挥发后取出。在结晶皿底部附着一层均匀的催化剂薄膜, 自然冷却后备用。实验中所用光源是主波长为 365nm 的紫外灯, 薄膜距光源15 cm, 薄膜处的光强为1.2 mW/cm 2 。
在已经制备好的两种催化剂薄膜上, 逐渐滴加200mL 用 2g/L 的储备液配制好的 EE2 溶液(1 mg/L)。将两个结晶皿置于暗态, 吸附 3 小时, 保证吸附达到平衡。打开紫外灯(反应开始前, 紫外灯预热 30 分钟)开始光催化反应, 在光催化反应的 6小时过程中, 每隔半小时用注射器取样, 用 0.22 µm 水系滤头过滤 1mL, 使用 LC-MS 测定样品的EE2浓度。
同样配置 1mg/L 的 EE2 溶液, 分别加入富里酸 FA (2.5, 5.0 和 7.5mg/L TOC)和 Fe 3+ (1.12, 2.80和 5.60mg/L)溶液, 考察 FA 及 Fe 3+ 离子存在条件下对膜催化的影响。光催化反应实验的操作方法如前所述。
在研究光催化降解有机物的过程中, 最常用的动力学模型为一级动力学模型:
ln( C t / C 0 )=- k t , (1)
式中, C t 代表反应 t 时刻的物质浓度(µg/L), C 0 代表反应初始时刻的物质浓度(µg/L), k 代表拟一级动力学方程的速率常数。
采用高效液相色谱–质谱联用仪(LC-MS)测定EE2和中间产物。
LC-MS 仪器的分析条件如下: 流动相为甲醇和水, 在对 EE2 进行定量的过程中, 甲醇的比例始终维持在 75%(体积比, 下同), 流速为 0.18 mL/min, 样品测定的停止时间为 6 分钟。中间产物采用梯度洗脱的方法: 甲醇的初始比例为 25%, 在 15 分钟内线性递增至 75%, 保持该流动相比例 30 分钟, 然后在 10 分钟内将甲醇浓度降低至 25%, 并保持该流动相 15 分钟。采用 MS 和 MS/MS 两种模式对中间产物进行定性分析, 扫描范围为 m / z= 50~400, 破碎电压为1.3 eV。
2.1.1 FTIR
实验所用 TiHAP 的傅里叶红外光谱如图 1 所示, 1014和1012 cm −1 处的吸收峰对应PO 4 3− 的非对称伸缩振动峰, 962 cm −1 处的峰对应PO 4 3− 的对称伸缩振动峰, 608和561 cm −1 处的峰对应PO 4 3− 的弯曲振动峰, 476 cm −1 处的峰对应PO 4 3− 的振动吸收峰。这些均与 HAP 标准物质的红外光谱相吻合 [25] , 但在 561cm −1 附近出现了 TiO 2 中 Ti—O 的伸缩振动 峰 [26] 。由此看出, TiHAP 具有 HAP 的吸收特征峰, 同时, 由于 Ti 元素的加入, 使其出现 TiO 2 的特征吸收峰。
2.1.2 比表面积(BET)
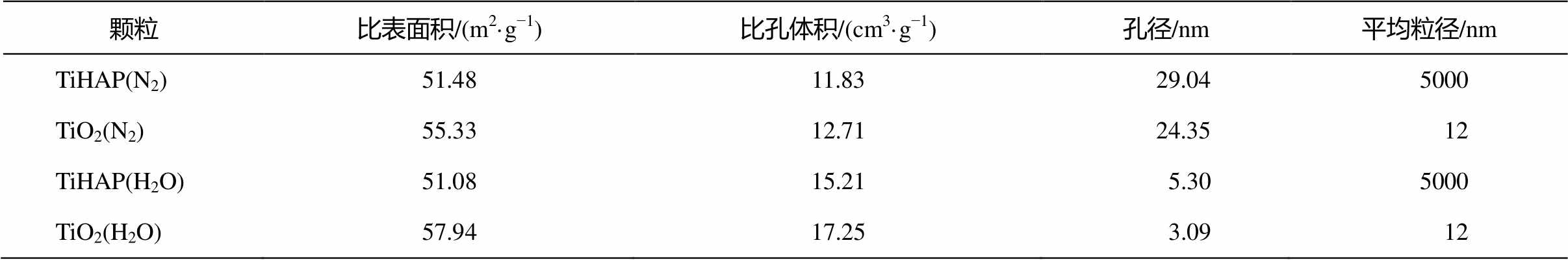
TiHAP 与 TiO 2 的氮气和水蒸气吸附–脱附等温线如图 2 所示。可以看出, TiHAP 为多孔性结构, 且由氮气和水蒸气吸附–脱附等温曲线的对比可知, TiHAP 有较强的亲水性。根据吸附–脱附等温曲线及其滞后回环的形状可知, TiHAP 样品的孔属于H3 型的狭缝孔, 它是一种平板间隙孔。同种气体测得样品的比表面积、比孔体积、孔径及粒径结果见表 1, 可以看出, 两种样品的比表面积、孔容及孔径都比较接近, 但 TiHAP 的粒径大于TiO 2 。

图1 TiHAP的红外光谱
Fig. 1 FTIR spectrum of TiHAP

图2 催化剂氮气((a)和(b))和水蒸气((c)和(d))吸附–脱附等温曲线
Fig. 2 N 2 ((a) and (b)) and H 2 O ((c) and (d)) adsorption-desorption isotherms of TiHAP
表1 BET测定数据
Table 1 Experiment data of BET
如图3所示, 催化反应进行6小时后, EE2能够被催化剂 TiHAP 和 TiO 2 膜光催化降解, 且降解效果明显。对比两种催化剂可知, TiHAP 的催化效果好于 TiO 2 , 二者的反应速率常数 k 分别为 0.228 和0.132 h −1 。Tsukada 等 [27] 在通过漫反射光谱研究HAP, TiHAP 和 TiO 2 的带系能量时, 指出 3 种催化剂的带系能量分别为>6 eV, 3.65 eV和3.27 eV。该研究指出, 由于 Ti 元素的引入, 导致 TiHAP 的带系宽度变窄, 使其能够吸收波长更长的紫外光。虽然 TiHAP 的带系宽度仍然大于 TiO 2 , 但其光催化性能有很大的提高。一般认为, 有机物在催化剂表面吸附是进行光催化反应的前提。很多研究表明, 增强催化剂的吸附性能可以提高催化剂的光催化能力 [27–28] 。在本实验中, 催化剂粉末被固定成膜状, 由于 TiHAP 具有比 TiO 2 更强的吸附性能, 提高了降解效率, 因此TiHAP的光催化性能比TiO 2 强。
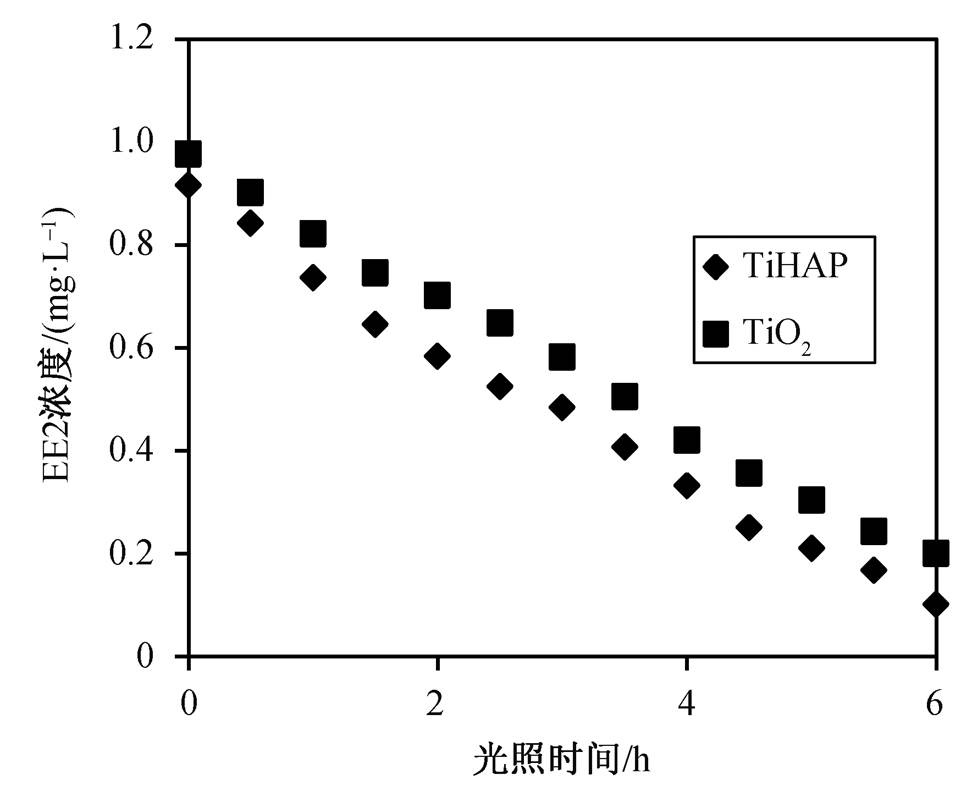
图3 TiHAP和TiO 2 薄膜光催化降解EE2
Fig. 3 Photocatalytic degradation of EE2 by TiHAP and TiO 2
富里酸(FA)和 Fe 3+ 广泛存在于水体中, 会影响纳米颗粒的沉淀、吸附和光吸收作用 [29] 。因此, 本研究探讨 FA 和 Fe 3+ 离子对两种催化剂膜催化实验的影响。图 4(a)和(b)分别为不同 Fe 3+ 浓度和 FA 浓度影响下 TiHAP 和 TiO 2 膜催化实验的降解速率常数变化。
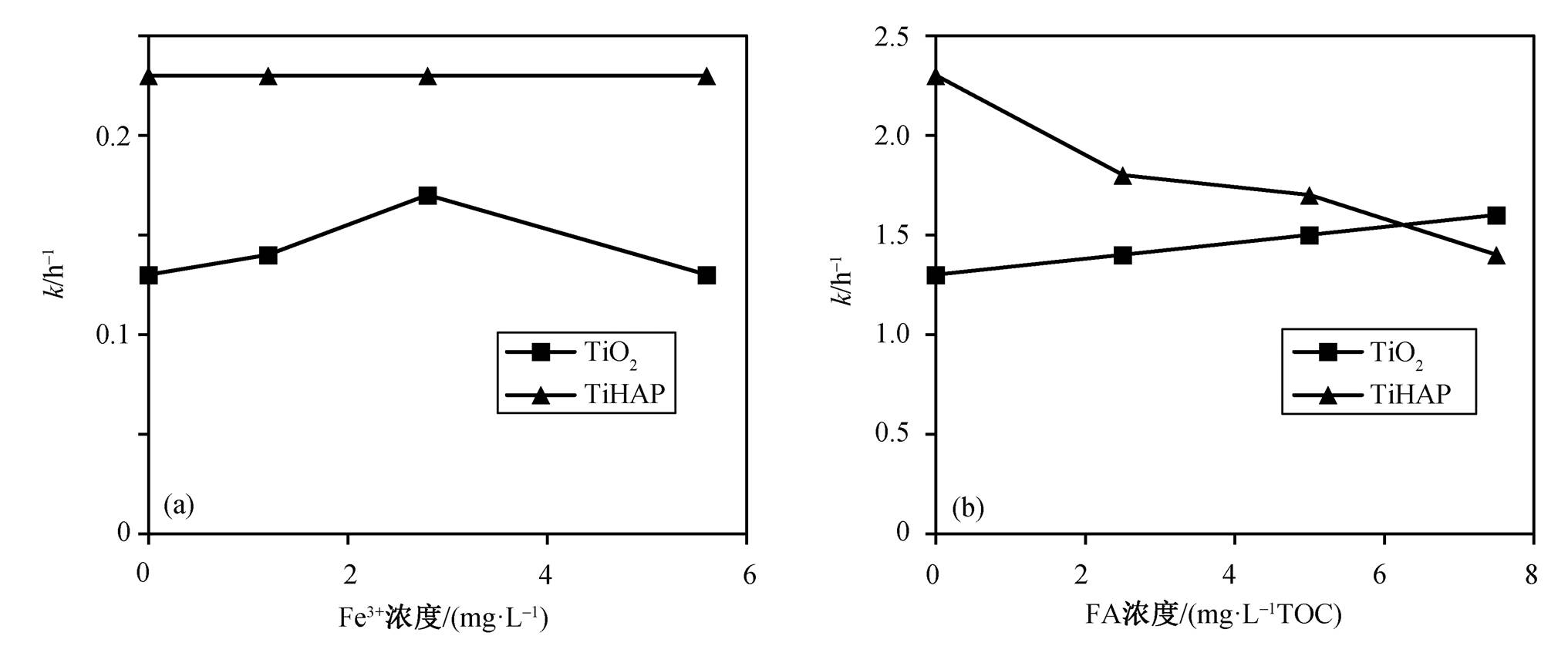
图4 Fe 3+ (a)和FA (b)浓度对膜光催化的影响
Fig. 4 Effect of Fe 3+ (a) and FA (b) concentration on photocatalytic degradation
表2 膜光催化实验反应前后Fe 3+ 和FA浓度变化
Table 2 Concentration variation of Fe 3+ and FA during photocatalytic degradation
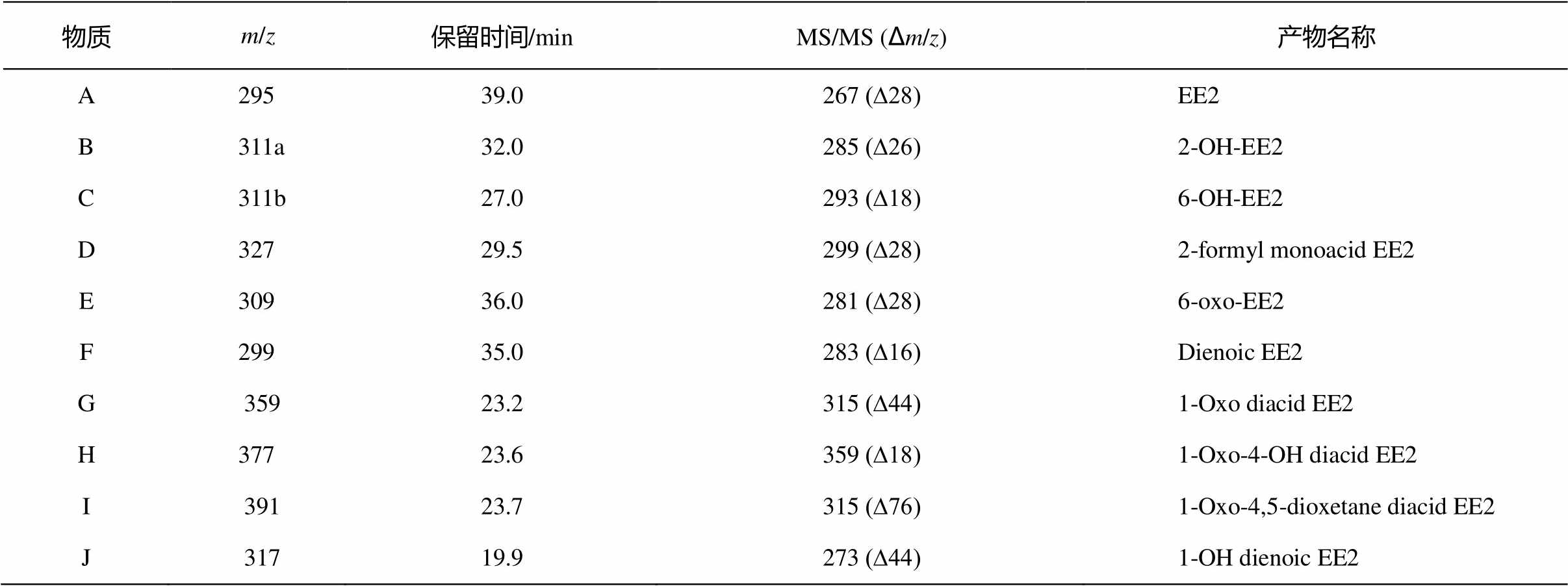
从图 4(a)可以看出, 随着Fe 3+ 浓度的增加, TiHAP 的降解速率没有明显变化, 而TiO 2 的降解速率呈先增加后减小的趋势。这是由于 TiHAP 对Fe 3+ 有强烈的吸附作用 [30] , Fe 3+ 通过与Ca离子置换而进入 TiHAP 晶格的内部。从表 2 可以看出, 在TiHAP 体系中反应后, Fe 3+ 几乎完全被吸附, 从而使溶液中基本上没有 Fe 3+ 存在, 因此对 TiHAP 的光催化降解没有明显影响。在 TiO 2 膜实验体系中, 随着 Fe 3+ 浓度增加, TiO 2 的降解速率呈先增加后减小的趋势。在低浓度范围内, Fe 3+ 能够捕获光生电子, 增加电子–空穴分离效率, 并促进羟基自由基产生 [31–32] , 进而促进光催化反应。然而, 随着 Fe 3+ 浓度的进一步增加, 降解效率减慢。这是由于随着Fe 3+ 浓度增加, 反应体系的颜色越来越深, 不利于TiO 2 对紫外光的吸收,使得降解效率有所下降。从表 2 中也不难看出, 在 TiO 2 体系中反应后, 由于TiO 2 吸附性能相对较差, 使得Fe 3+ 离子减少并不 显著。
从图 4(b)可以看出, 随着 FA 浓度增加, TiO 2 的降解速率逐渐升高, TiHAP 的降解速率逐渐降低。这是因为在紫外光的照射下, FA 能够被激发而起到光敏化剂的作用, 从而促进光催化降解 [33] 。随着 FA 浓度增加, TiHAP 催化作用的降解速率下降, 这主要是由于 FA 能被 TiHAP 表面吸附(见表2), 从而抑制了羟基自由基的产生 [34] , 因此降低了TiHAP降解EE2的速率。
2.4.1 中间产物随时间变化规律
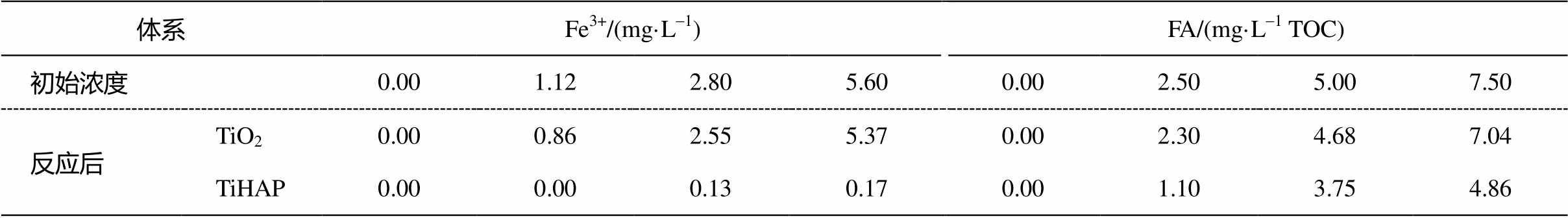
为了更好地分析 EE2 降解过程中的中间产物, 选择 EE2 的初始浓度为 5 mg/L, TiHAP 的浓度为500 mg/L。降解曲线如图 5 所示, 可以看出, EE2在50小时内几乎完全降解。
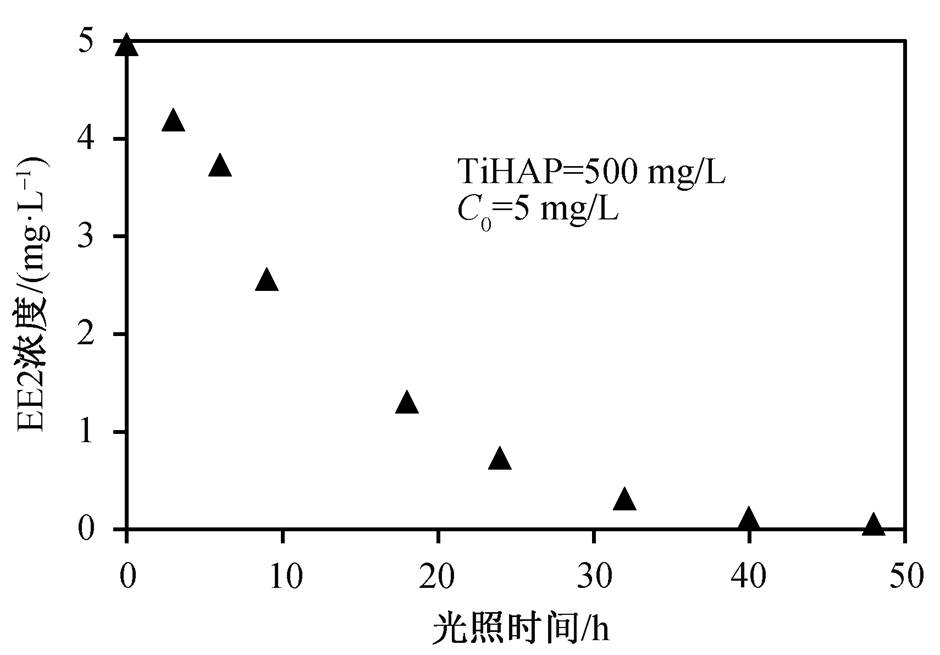
图5 TiHAP降解EE2曲线
Fig. 5 Photocatalytic degradation of EE2 by TiHAP
采用 LC-MS 梯度洗脱的方法确定中间产物, 结果如图6所示, 在样品的总离子流色谱图(TIC)中出现 6 个比较明显的物质峰, 保留时间分别为18.0~19.9, 21.1~25.1, 26.5~27.7, 31.3~34.6, 35.0~ 37.1 和 38.3~39.5 分钟。图 7 为这些物质峰的平均质谱图。
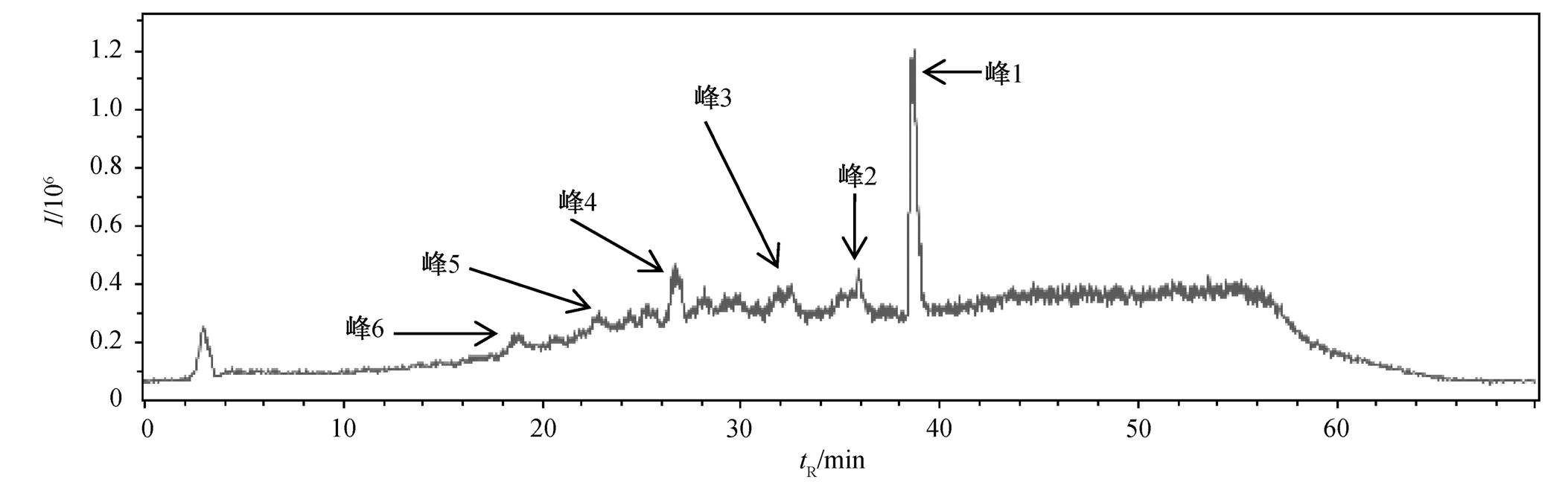
图6 EE2光催化样品总离子流谱
Fig. 6 TIC spectrum of EE2 sample
如图 7 所示, 从对应的 TIC 图的 6 个物质峰中, 可以提出 9 种离子, 分别为 m / z 317, m / z 359, m / z 377, m / z 391, m / z 299, m / z 311, m / z 327, m / z 309和 m / z 295。采用LC-MS一级质谱分析光催化降解过程中的中间产物以及不同产物的出峰时间, 结果如表 3 所示。
对提取出的中间产物离子流色谱峰积分, 计算每个离子的峰面积, 从不同时刻反应产物的峰面积推断出每种产物在光催化反应过程中的浓度变化趋势, 结果如图 8 所示。与 EE2 标准物质对比, m / z 295为EE2物质峰, 该物质峰出现在反应初始的 0时刻, 并随着光催化反应的进行逐渐减少。就产物 m / z 311 而言, 由于梯度洗脱法中的不同出峰时间代表不同的物质, 并且在实际检测中 m / z 311 在两个不同的时间分别出峰, 因此可以断定在产物的形成过程中有两种不同的物质, 其 m / z 均为 311。这里, 根据不同的出峰时间, 将其分别命名为 311a 和311b。
图8(a)和(b)反映光催化反应过程中所检测出中间产物的物质峰峰面积的演变过程。这些物质峰( m / z 317, m / z 359, m / z 377, m / z 391, m / z 299, m / z 311a, m / z 311b, m / z 327和 m / z 309)的峰面积均随着反应进程而呈现先增大后减小的趋势。随着光催化反应的进行, 产物浓度均逐渐增加, 达到峰值, 然后随着光催化反应的继续进行, 这些产物也不断地被降解, 浓度逐渐降低。据此可以认为, 这些物质为光催化降解 EE2 过程中形成的中间产物。在随后的分析过程中, 采用二级质谱的方法来进一步确认其分子结构。
图7 物质峰的平均质谱
Fig. 7 Average LC-MS spectra of intermediates peaks
表3 EE2降解过程中的主要中间产物
Table 3 Main intermediates in EE2 degradation
2.4.2 中间产物结构分析
为了确定中间产物的分子结构, 采用 LC-MS/ MS 分析, 结果如图 9 与表 3 所示。图 9 展示了每种中间产物经 MS/MS 质谱打碎后的主要碎片离子。根据二级质谱 m / z 的变化, 可以推测相应的碎片离子, 其中∆16, ∆18, ∆26, ∆28, ∆44, ∆62, ∆72和∆76分别为中性分子丢失O, H 2 O, C 2 H 2 , CO, CO 2 , (CO 2 和H 2 O), (CO 2 和CO)和(CO 2 和O 2 )。
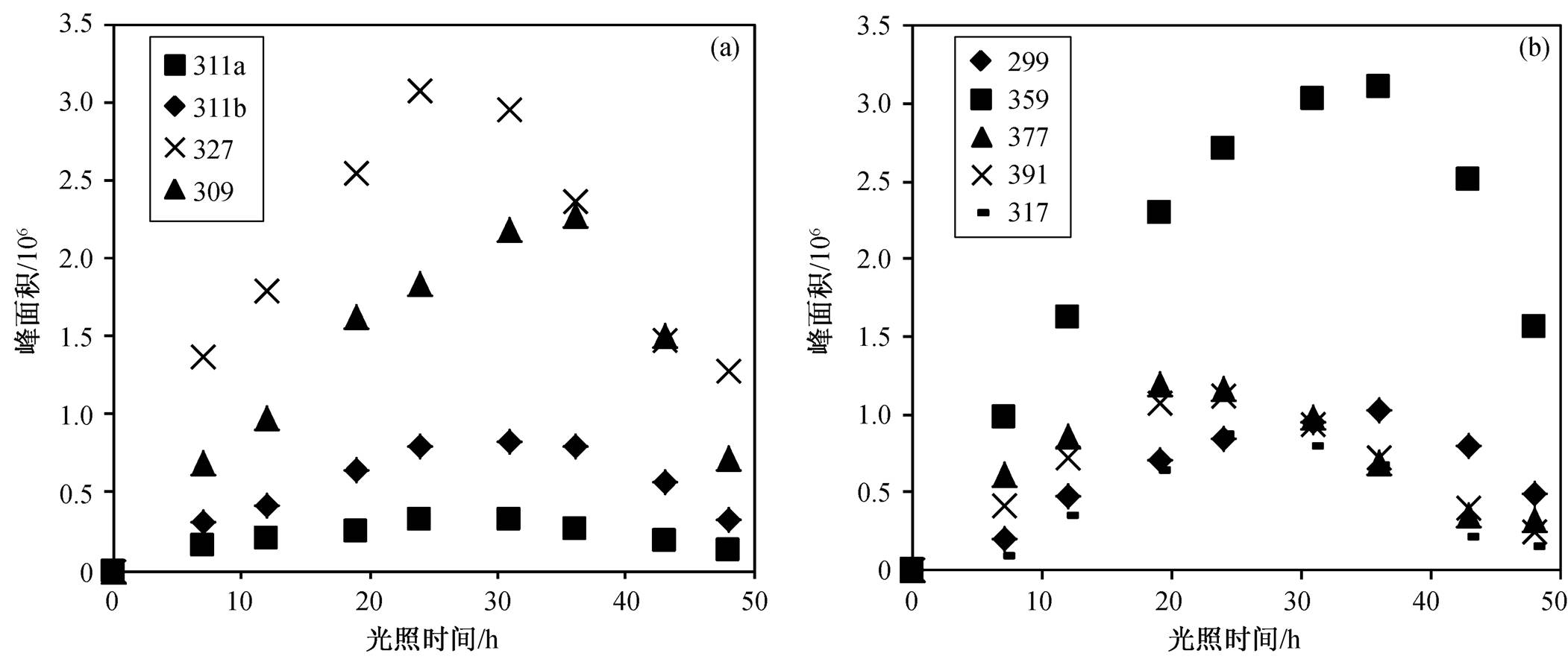
图8 光催化降解过程中EE2及其中间产物离子含量变化
Fig. 8 EE2 and intermediates concentration during photocatalytic degradation
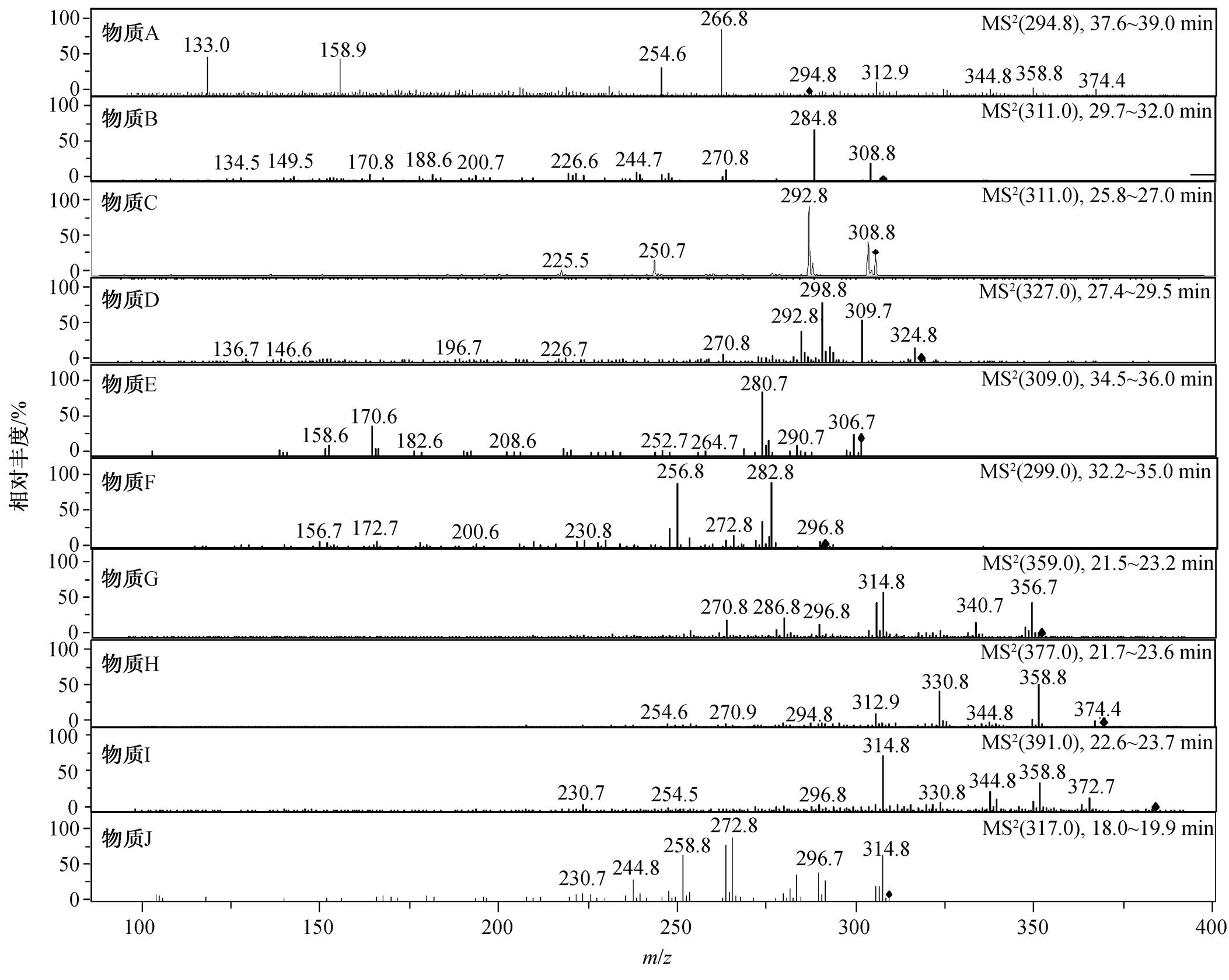
图9 EE2中间产物LC-MS/MS的二级质谱
Fig. 9 LC-MS/MS spectra of EE2 intermediates
与标准物质的二级质谱图对比, 确定物质 A 为EE2。 m / z 311 分别在两个不同的梯度洗脱时间出峰, 其保留时间分别为27.0分钟(物质B)和 32.0分钟(物质 C)。这两种物质可能是由于EE2分子结构中增加羟基而形成。在物质 B 的 MS 2 质谱中, 一个碎片离子是 m / z 285, 是由于乙炔基(C 2 H 2 )基团断裂而形成。因此, 物质 B 被鉴别为 2-OH-EE2。物质C的MS 2 质谱中的碎片离子与物质B不同, 出现碎片离子 m / z 293, 表明物质C丢失了一分子的H 2 O。研究表明, 在与 EE2 反应的过程中, •OH 自由基能够在酚环中加入羟基或者从脂肪环中提取氢 [35] , 因此物质 C 是由于•OH 自由基攻击 EE2 脂肪环中的 C6 原子而形成 [36] , 物质 C 鉴别为 6-OH-EE2。Mazellier 等 [37] 在EE2直接光解的研究中也发现链接在芳族环上的脂肪碳被氧化, 也为本实验结果提供了证据。•OH 自由基进一步攻击 2-OH-EE2中的芳族环, 形成 2-formyl monoacid EE2 (物质D, m / z 327)。此外, 物质D的MS 2 质谱也证实在分子结构中存在醛基/酮基和羧基 [38] 。物质 E ( m / z 309)的分子量比物质 C 少 2。研究表明, 如果•OH自由基在EE2的C6位置上提取氢, 6-oxo EE2是其中的一种氧化产物 [35] 。此外, m / z 309离子的碎片离子为 m / z 281, 也表明在C6位置上的酮基失去一分子CO。因此, 物质E鉴别为6-oxo EE2。
基于以前研究结果 [35,39–40] 中 EE2 和 E2 的氧化产物, 物质 G ( m / z 359)鉴别为 1-oxo-diacid EE2。物质 H ( m / z 377)的分子量比1-oxo-diacid EE2 ( m / z 359)大 18, 可能是由于在 C4 和 C5 之间的双键加入一分子水。因此, 物质 H 鉴别为 1-oxo-4-OH diacid EE2。如果在 C4 位置加入 •OOH, 能够产生1-OH-4,5-dioxetane diacid EE2 (物质I, m / z 391)。研究表明, 物质F ( m / z 299)与muconic EE2丢失一分子 CO 2 所形成的碎片离子结构相同 [41] 。因此, 物质 F 为 muconic EE2 进一步反应的产物, 命名为dienoic EE2。
为了进一步确定 m / z 317 的结构, 采用三级质谱分析, 结果如图10所示。
m / z 317的二级与三级碎片离子分别为 m / z 273与 m / z 245。由多级质谱图可知, 其主要的碎片离子与母离子分子量相差 44 和 28, 因此可知其分子结构中存在醛基/酮基和羧基 [38] 。并对比 Sun 等 [41] 的研究中检测到的 m / z 299可知, m / z 317与其分子量相差18, 是由 m / z 299分子中的双键加入一分子水形成, 因此, 物质 J 鉴别为1-OH-dienoic EE2。
从表 3 可以看出, 所检测出的中间产物的碎片离子( m / z 317 除外)均与 Sun 等 [41] 研究中检测的主要碎片离子相同, 可以进一步确定本研究检测出的中间产物与 Sun 等的研究相同。这与 Grabowska 等 [42] 和Fotioua等 [43] 的结论相同。Grabowska等 [42] 的研究表明, 苯酚光催化降解的主要中间产物相同, Fotioua等 [43] 在研究多金属氧酸盐(SiW 12 O 40 4− )与TiO 2 降解GSM与MIB的过程中发现, 两种催化剂在相同的条件下光催化降解同一种物质时, 产生的主要中间产物基本上相同。对比 Sun 等 [41] 的研究结果可知, 本研究在中性条件下检测出的中间产物离子明显更多, 这可能是降解速率的影响所致。
2.4.3 反应途径分析
光催化过程中, 在紫外光照射下, 催化剂表面会产生电子–空穴对, 价带的空穴是很好的氧化剂, 大多数有机物在光催化氧化过程中都会直接或者间接地被空穴氧化 [44] , 使得光催化的氧化过程不同于其他高级氧化过程。氧是光催化过程所必须的, 它能够促进形成活性物质或者直接参加自由基的氧化反应 [45–46] 。在光催化过程中形成的自由基主要为•OH, •OOH, •O 2 − 和导带的电子。EE2光催化降解的反应机理如反应式(2)~(5)所示:
TiHAP+hν→e − +h + , (2)
h + +H 2 O→•OH+H + , (3)
e − +O 2 + H + →•O 2 − + H + →•OOH, (4)
h + /•OH+EE2→氧化产物。 (5)
研究表明, •OH首先攻击的是EE2分子结构中的 C2 位置 [40,47–48] 。由于光催化降解有机物的主要途径是羟基化、羧基化和脱羧等系列反应 [49–50] , 结合检测出的 9 种中间产物的结构, 可以推测EE2降解的主要途径为 TiHAP 在紫外光的照射下产生电子和空穴对, 并由此产生羟基等自由基, 对 EE2 进行氧化降解。主要过程如下: 所产生的羟基自由基首先攻击电子密度较大的碳原子, 使其苯环羟基化; 然后, 羟基自由基继续氧化, 使苯环开环并羧基化, 继续通过氧化使其发生脱羧或脱羰基等系列反应, 逐步降解EE2。本研究中的两种主要降解途径如图11所示。
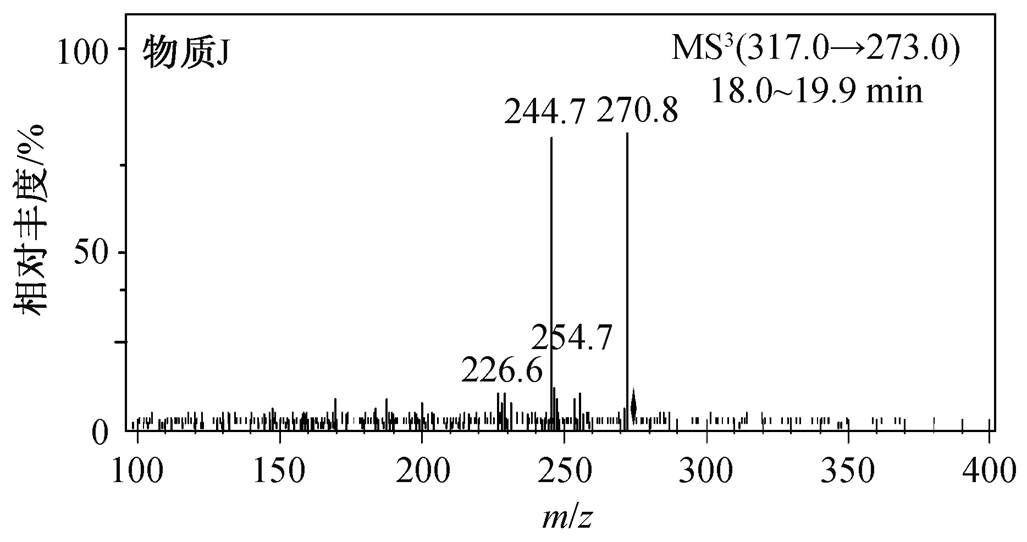
图10 m / z 317的三级质谱
Fig. 10 LC-MS 3 spectrum of m / z 317
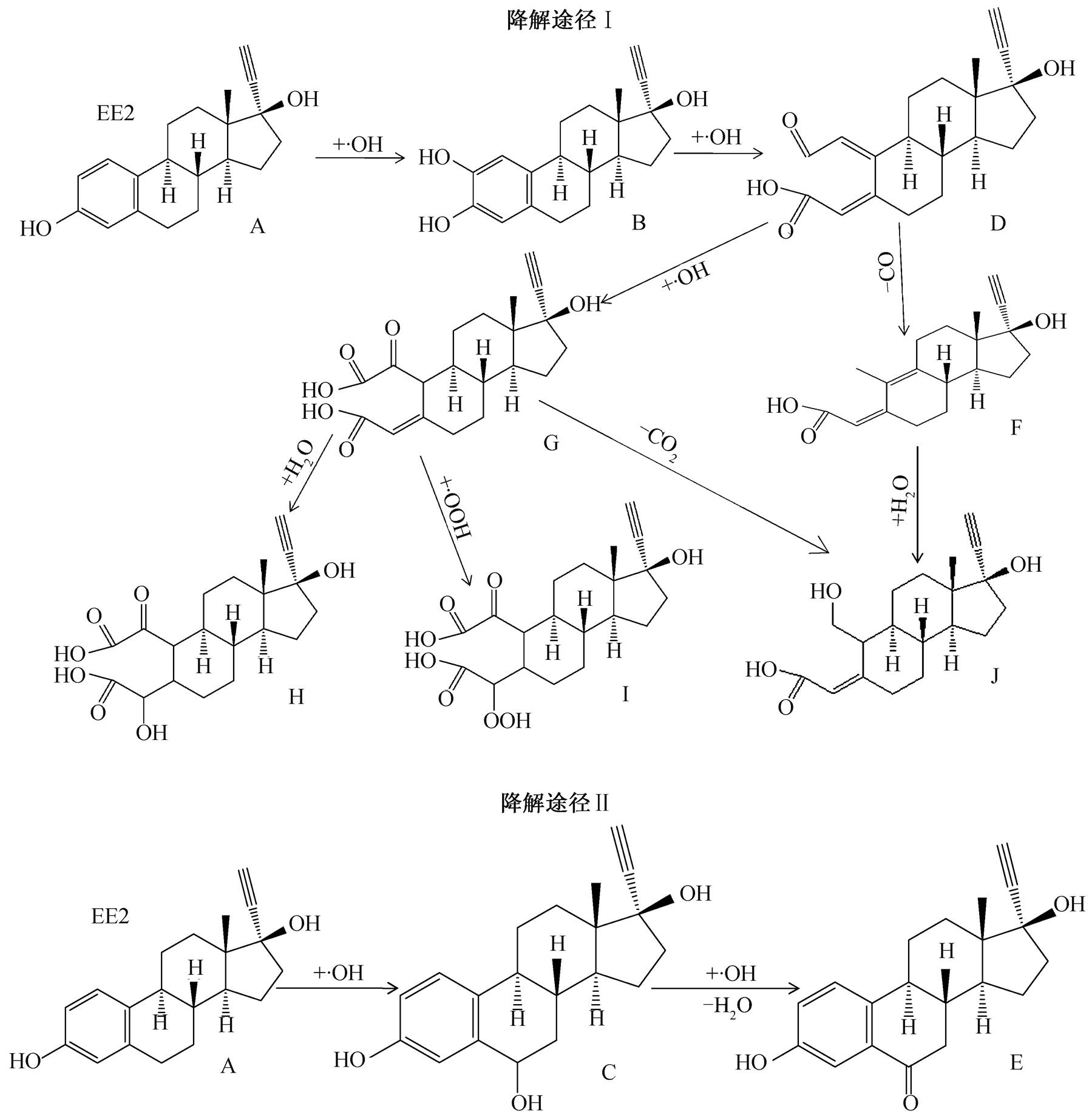
图11 EE2的降解途径
Fig. 11 Reaction pathways of EE2 degradation
本文采用载钛羟基磷灰石(TiHAP)作为催化剂, 以 EE2 为目标污染物, 对比了 TiHAP 与 TiO 2 薄膜光催化降解 EE2 的性能, 并考察了 Fe 3+ 与富里酸(FA)对两种催化降解 EE2 速率的影响。利用 LC-MS n 分析了 TiHAP 光催化降解 EE2 的中间产物, 并据此推断了EE2的降解途径和机理, 得到如下主要结论。
1)对比 TiHAP 和 TiO 2 薄膜对 EE2 的降解规律, 由于 TiHAP 对 EE2 较强的吸附能力而促进其对 EE2 的降解, 因此 TiHAP 对 EE2 的降解速率大于 TiO 2 。
2)随着Fe 3+ 离子浓度增加, TiHAP降解EE2的速率没有明显变化, 而 TiO 2 降解 EE2 的速率呈现先增大、后减小的趋势。随着 FA 浓度的增加, TiHAP 降解 EE2 的速率减小, 而 TiO 2 降解效率升高。这是由于 Fe 3+ 离子的引入能够捕获光生电子, 增加电子–空穴分离效率, 并促进羟基等自由基的形成, 且光照激发后 FA 能够起到敏化剂作用, 从而促进其光催化, 但 Fe 3+ 离子浓度过高影响TiO 2 吸光而抑制其催化。在 TiHAP 薄膜体系中, 大部分Fe 3+ 被吸附, 因此对 EE2 催化降解没有影响, 同样吸附在TiHAP薄膜表面的FA抑制了TiHAP产生羟基等自由基, 从而抑制了 TiHAP 光催化降解EE2。
3)在中性 pH 条件下, 共检测出 9 种降解产物, 比同样pH条件下以TiO 2 为催化剂检出的产物种类多。TiHAP 降解 EE2 的主要途径为, 羟基等自由基首先攻击电子密度较大的苯环 C2 原子, 使其苯环羟基化, 然后羟基等自由基继续氧化, 使苯环开环并羧基化, 继而发生脱羧或脱羰基等系列反应, 逐步降解 EE2。次要途径为, 羟基自由基攻击与苯环相连的碳环, 然后进一步降解EE2。
参考文献
[1]Segner H K, Caroll M, Fenske C, et al. Identification of endocrine-disrupting effects in aquatic vertebrates and invertebrates: report from the European IDEA project. Ecotoxicology and Environmental Safety, 2003, 54(3): 302–314
[2]Beck I, Bruhn R, Gandrass J, et al. Liquid chro-matography-tandem mass spectrometry analysis of estrogenic compounds in coastal surface water of the Baltic Sea. Journal of Chromatography A, 2005, 1090 (1/2): 98–106
[3]Yokota H, Miyashita N, Yuasa A. High glucuronidation activity of environmental estrogens in the Carp ( Cyp-rinus Carpino ) Intestine. Life Sciences, 2002, 71(8): 887–898
[4]赵劲松, 袁星. 环境激素对鱼的影响. 环境科学研究, 2001, 14(3): 12–16
[5]Desbrow C, Routledge E J, Brighty G C, et al. Identification of estrogenic chemicals in STP Effluent. 1. Chemical fractionation and in vitro biological scree-ning. Environment Science & Technology, 1998, 32 (11): 1549–1558
[6]Routledge E J, Sheahan D, Desbrow C, et al. Iden-tification of estrogenic chemicals in STW effluent. 2. In vivo responses in trout and roach. Environmental Sci-ence & Technology, 1998, 32(11): 1559–1565
[7]Bouman A, Heineman M J, Faas M M. Sex hormones and the immune response in humans. Humans Reprodu-ction Update, 2005, 11(4): 411–423
[8]Karpova T, Preis S, Kallas J. Selective photocatalytic oxidation of steroid estrogens in presence of saccha-rose and ethanol as co-pollutants. Environmental Che-mistry Letter, 2007, 5(4): 219–224
[9]Babel S, Kurniawan T A. Low-cost adsorbents for heavy metals uptake from contaminated water: a re-view. Journal of Hazardous Materials B, 2003, 97 (1/2/3): 219–243
[10]Ren Y X, Nakano K, Nomura M, et al. A thermody-namic analysis on adsorption of estrogens in activated sludge process. Water Research, 2007, 41(11): 2341–2348
[11]Rivera-Utrilla J, Sánchez-Polo M, Gómez-Serrano V, et al. Activated carbon modifications to enhance its water treatment applications: an overview. Journal of Hazar-dous Materials, 2011, 187(1/2/3): 1–23
[12]白刚, 李咏梅. 温度对 17 α -乙炔雌二醇在 SBR 工艺中去除效果的影响. 环境污染与防治, 2009, 31(2): 27–30
[13]时文歆, 赵丽晔, 李冠洋, 等. 生态塘中 17α-块雌醇的去除途径与机制. 哈尔滨工业大学学报, 2010, 42(8): 1269–1273
[14]邢洁, 杨基先, 庞长泷, 等. 生物絮凝剂产生菌的鉴定及对 EE2 的去除效能. 中国给水排水, 2013, 29 (11): 11–14
[15]Feng Y J, Zhang Z H, Gao P, et al. Adsorption behavior of EE2 (17 alpha-ethinylestradiol) onto the inactivated sewage sludge: kinetics, thermodynamics and influence factors. Journal of Hazardous Materials, 2010, 175 (1/2/3): 970–976
[16]Layton A C, Gregory B W, Seward J R, et al. Mineralization of steroidal hormones by biosolids in waste water treatment Systems in Tennessee USA. Environmental Science & Technology, 2000, 34(18): 3925–3931
[17]唐凯, 马晓雁, 李青松, 等. 高锰酸钾对水中 17 α -乙炔基雌二醇去除效果的研究. 给水排水, 2012, 38(11): 132–136
[18]张骞, 周莹, 张钊, 等. 表面等离子体光催化材料. 化学进展, 2013, 25(12): 2020–2027
[19]王萍, 李国昌. 羟基磷灰石微球制备及离子吸附/交换性能研究. 人工晶体学报, 2012, 41(3): 821–827
[20]朱婷婷. 不同类型羟基磷灰石的制备及其对重金属离子吸附行为的研究[D]. 济南: 济南大学, 2011
[21]张定林, 赵华文, 赵先英, 等. 羟基磷灰石作催化剂和催化剂载体的应用. 化学进展, 2011, 23(4): 687–694
[22]Wakamura M, Tanaka H, Naganuma Y, et al. Surface structure and visible light photocatalytic activity of titanium-calcium hydroxyapatite modified with Cr(III). Advanced Powder Technology, 2011, 22(4SI): 498–503
[23]Nishikawa H. A high active type of hydroxyapatite for photocatalytic decomposition of dimethyl sulfide under UV irradiation. Journal of Molecular Catalysis A: Chemical, 2004, 207(2): 149–153
[24]Li Q, Feng X, Zhang X, et al. Photocatalytic degra-dation of bisphenol a using Ti-substituted hydroxya-patite. Chinese Journal of Catalysis, 2014, 35(1): 90–98
[25]应育浦, 汪寿松. 矿物的红外光谱. 北京: 科学出版社, 1982
[26]孙丽萍, 高山, 赵辉, 等. 锐钛矿型二氧化钛纳米粉体的 IR 光谱与光催化性能研究. 光散射学报, 2004, 15(4): 300–302
[27]Tsukada M, Wakamura M, Yoshida N, et al. Band gap and photocatalytic properties of Ti-substituted hydro-xyapatite: comparison with anatase-TiO 2 . Journal of Molecular Catalysis A: Chemical, 2011, 338(1/2): 18–23
[28]李宁, 盛义平, 王秀丽, 等. TiO 2 -AC-PTFE光阳极的制备及光电催化降解苯酚. 环境化学, 2010, 29(4): 710–716
[29]Li S, Sun W L. A comparative study on aggregation/ sedimentation of TiO 2 nanoparticles in mono- and binary systems of fulvic acids and Fe(III). Journal of Hazardous Materials, 2011, 197(24): 70–79
[30]钱功明, 周珍旭, 王发杰, 等. 羟基磷灰石去除废水中的Fe3 + . 化工环保, 2013, 33(2): 115–118
[31]Zhang J W, Fu D F, Gao H Y, et al. Mechanism of enhanced photocatalysis of TiO 2 by Fe 3+ in suspen-sions. Applied Surface Science, 2011, 258(4): 1294–1299
[32]尚静, 薛莲, 李佳, 等. 全固态平面型ITO/Fe3 + -TiO 2 /ITO光电催化器件的制备和催化性能. 催化学报, 2008, 29(10): 1037–1042
[33]Chen J L, Ravindran S, Swift S. Catalytic oxidative degradation of 17 α -ethinylestradiol by Fe III -TAML/ H 2 O 2 : estrogenicities of the products of partial, and extensive oxidation. Water Research, 2012, 46(19): 6309–6318
[34]Li Si, Sun Weiling. Photocatalytic degradation of 17 α -ethinylestradiol in mono- and binary systems of fulvic acid and Fe(III): application of fluorescence excitation/emission matrixes. Chemical Engineering Journal, 2014, 237: 101–108
[35]Lee Y, Escher B I, von Gunten U. Efficient removal of estrogenic activity during oxidative treatment of waters containing steroid estrogens. Environmental Science & Technology, 2008, 42(17): 6333–6339
[36]Zhao Y, Hu J, Jin W. Transformation of oxidation products and reduction of estrogenic activity of 17 β -estradiol by a heterogeneous photo-fenton reaction. Environmental Science & Technology, 2008, 42(14): 5277–5284
[37]Mazellier P, Méité L, Laat J. Photodegradation of the steroid hormones 17 β -estradiol (E2) and 17 α -ethiny-lestradiol (EE2) in dilute aqueous solution. Chemosphere, 2008, 73(8): 1216–1223
[38]Carp O, Huisman C, Reller A. Photoinduced reactivity of titanium dioxide. Progress in Solid State Chemistry, 2004, 32(1/2): 33–177
[39]Huber M M, Ternes T A, von Gunten U. Removal of estrogenic activity and formation of oxidation pro-ducts during ozonation of 17 α -Ethinylestradiol. Envir-onmental Science & Technology, 2004, 38(19): 5177–5186
[40]Mai J, Sun W, Xiong L, et al. Titanium dioxide medi-ated photocatalytic degradation of 17 beta-estradiol in aqueous solution. Chemosphere, 2008, 73(4): 600–606
[41]Sun W L, Li S, Mai J X, et al. Initial photocatalytic degradation intermediates/pathways of 17 α -ethyny les-tradiol: effect of pH and methanol. Chemosphere, 2010, 81(1): 92–99
[42]Grabowska E, Reszczynska J, Zaleska A. Mechanism of phenol photodegradation in the presence of pure and modified-TiO 2 : a review. Water Research, 2012, 46(17): 5453–5471
[43]Fotioua T, Triantisa T M, Kaloudis T, et al. Photoca-talytic degradation of water taste and odour compounds in the presence of polyoxometalates and TiO 2 : inter-mediates and degradation pathways. Journal of Photo-chemistry and Photobiology A: Chemistry, 2014, 286 (15): 1–9
[44]Hoffmann M R, Martin S T, Choi W Y, et al. Envi-ronmental applications of semiconductor photocataly-sis. Chemical Reviews, 1995, 95(1): 69–96
[45]Schwitzgebel J, Ekerdt J G, Gerischer H, et al. Role of the oxygen molecule and of the photogenerated electron in TiO 2 -photocatalyzed air oxidation reactions. Journal of Physical Chemistry, 1995, 99(15): 5633–5638
[46]Pichat P. A brief overview of photocatalytic mecha-nisms and pathways in water. Water Science Tech-nology: A Journal of the International Association on Water Pollution Research, 2007, 55(12): 167–173
[47]Kubli-Garfias C. Comparative study of the electronic structure of estradiol, epiestradiol and estrone by abinitio theory. Theochem — Journal of Molecular Stru-cture, 1998, 452(1/2/3): 175–183
[48]Yi T, Harper W F. The link between nitrification and biotransformation of 17alpha-ethinylestradiol. Environ-mental Science & Technology, 2007, 41(12): 4311–4316
[49]Lagunas-Allué L, Martínez-Soria M, Sanz-Asensio J. Degradation intermediates and reaction pathway of pyraclostrobin with TiO 2 photocatalysis. Applied Cata- lysis B: Environmental, 2012, 115/116: 285–293
[50]Liu Yanfang, Zhu Yanyan, Xu Jing, et al. Degradation and mineralization mechanism of phenol by BiPO 4 photocatalysis assisted with H 2 O 2 . Applied Catalysis B: Environmental, 2013, 142/143: 561–567
Photocatalytic Degradation and Reaction Pathway of EE2 in Aqueous Solution by TiHAP
JU Chuanlun 1,2 , ZHANG Jianwei 1,2 , SUN Weiling 1,2,† , Wakamurac Masato 3 , Tsukadad Mineharu 3 , Sasa Masaaki 4
1. Shenzhen Key Laboratory for Heavy Metal Pollution Control and Reutilization, School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Key Laboratory of Water and Sediment Sciences (MOE), Department of Environmental Engineering, Peking University, Beijing 100871; 3. Fujitsu Laboratories Limited, Atsugi 243-0000; 4. Fujitsu Research and Development Center Company Limited, Beijing 100025
Abstract Selecting 17α-ethynylestradiol (EE2) as the target pollutantand TiHAP as the catalyst, comparative studies of the photocatalyticdegradation of TiHAP and TiO 2 were conducted, and the influencing factors and intermediateproducts were also investigated. The results show thatthe EE2 degradation rate byTiHAP filmwas faster than that by TiO 2 film. The EE2 degradation rate of TiHAPremained the same with the increase of Fe 3+ concentration, butdecreased with the increase of FA concentration. For TiO 2 , the EE2 degradation rate initially increased and then decreased with increasing Fe 3+ concentration, and increased with increasing FA concentration.The photocataliticdegradation intermediates of EE2 by TiHAPwere identified by LC-MS n .The results show that nine kinds of intermediates were identified. Compared with TiO 2 , more kinds of intermediates were identified for EE2 photocatalytic degradation by TiHAP. Transformation of the phenolic moiety, hydroxylation, ring openingand carboxylation, and carboxylationwere the primary reaction pathways.
Key words TiHAP; EE2; photocatalysis
doi: 10.13209/j.0479-8023.2017.188
中图分类号 X132
收稿日期: 2017–03–20;
修回日期: 2017–05–09;
网络出版日期: 2018–06–27
† 通信作者 , E-mail:wlsun@pku.edu.cn
† Corresponding author , E-mail: wlsun@pku.edu.cn
日本富士通研究所环境能源研究中心基金(k120400)资助