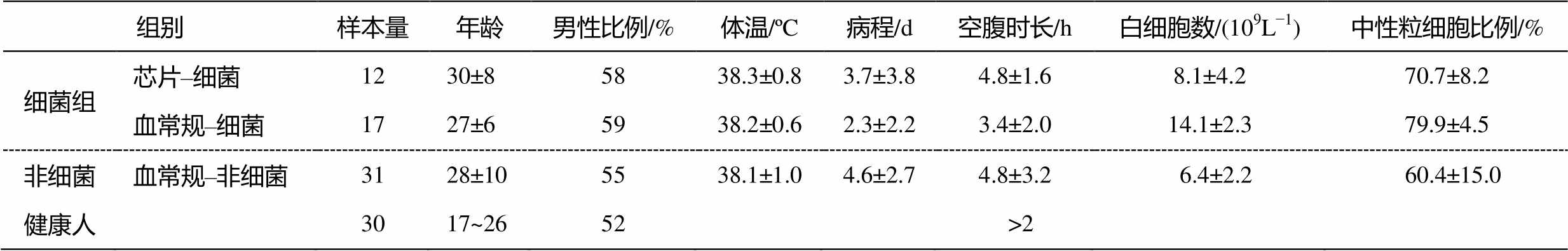
表1 病患及健康人基本信息
Table 1 Basic information of patients and healthy person
王珏 1 郑云昊 1 刘兆荣 1,† 要茂盛 1 李晓光 2 庄嘉 1 彭望远 1
1.北京大学环境科学与工程学院, 北京 100871; 2.北京大学第三医院感染疾病科, 北京 100191
摘要 研究健康人与病患呼出气VOCs成分的异同, 为上呼吸道感染分型的无创快速诊断提供信息。采集60例上呼吸道感染患者、30例健康人呼出气, 利用GC-MS定量检测97种VOCs, 分析健康人及病患呼出气中烷烃、烯烃、卤代烃、含氧烃、芳香烃等物质的分布特点, 并利用ANOVA-PCA, 分析室内空气以及健康人和病患呼出气中VOCs的异同。结果表明, 异戊二烯浓度在病患、健康人呼出气及室内空气中均有显著差异( P <0.05), 且呈现病人>健康人>室内空气的特点; 正戊烷浓度在病患组显著高于健康人组( P <0.05); 丙醛浓度在细菌性上感组显著高于健康组( P =0.019)。PCA分析结果显示, 健康人与上呼吸道感染病患呼出气差异明显, 不同类型病患呼出气VOCs没有明显差异。
关键词 呼出气VOCs; 上呼吸道感染; 健康人; ANOVA-PCA
呼出气中含有多种挥发性有机化合物(volatile organic compounds, VOCs), 能够表征人体的健康状态, 应用于疾病诊断的研究, 优点在于无创、快捷、可重复采样和适用于大规模的疾病筛查。自Pauling 等 [1] 发现人体呼出气内有200多种 VOCs以来, 关于呼出气VOC组分与疾病状态之间关联的研究日益增多, 如在对肺癌、糖尿病、乳腺癌等的研究 [2–15] 中, 通过对比病患与健康人呼出气VOCs成分和浓度水平差异, 可为VOCs疾病诊断模型的建立提供参考。以诊断模型为基础, 基于传感器技术的检测设备能对呼气VOCs进行无创、快速检测 [16] 。已有研究表明, 利用呼出气VOCs进行临床诊断, 特异性和敏感性均在70%以上 [17–19] 。
上呼吸道感染(简称上感)是最常见的感染性疾病, 病因复杂多样, 90%由病毒引起, 少数由细菌、衣原体、支原体引起 [20–23] 。细菌性感染与非细菌性感染需要采取不同的治疗措施。细菌性上感需用抗生素治疗, 而抗生素对非细菌性上感无效, 并且会增强致病菌的抗药性 [24] , 因此上感分型的诊断很重要。目前上感分型诊断最可靠的办法是实验室细菌检测, 但耗时过长, 多用于实验室研究, 不能作为临床诊断方法。因此, 科学家们结合实验室细菌检测结果, 通过对比细菌型上感和非细菌型上感血清中各成分含量差异, 得到有临床诊断意义的指标。研究表明, 中性粒–淋巴细胞比值、血清降钙素元、超敏C反应蛋白、白细胞介素等均有上呼吸道感染临床诊断意义 [25–27] , 然而, 这些临床诊断不但需要抽血化验, 而且可靠性也存在争议。分析人体呼出气中VOCs在不同健康状态的异同, 可为建立呼出气VOCs与疾病状态之间的联系提供信息, 有望为实现呼出气VOCs对上感分型的无创快速诊断提供重要信息。
本研究检测健康人、细菌性上感患者、非细菌性上感患者呼出气VOCs浓度, 并通过ANOVA-PCA分析, 针对呼出气VOCs在不同健康状态人群的异同进行讨论。
实验人群筛选标准: 上呼吸道感染患者来自某三甲医院发热门诊, 采样时间是2015年12月、2016年4月, 病患是经医生凭临床经验诊断为上呼吸道感染的患者, 主要症状为发热、咳嗽、嗓子痛、头晕恶心、四肢无力、流鼻涕、有痰等, 剔除有吸烟史、下呼吸道感染病史、重大病史以及空腹时长<2小时的样本, 共得到有效样本60例; 健康样本来自某高校师生, 采样时间是2015年11月, 选择年龄在20~26岁之间、健康状况良好的样本, 剔除一周内有感冒症状、有呼吸道疾病病史以及空腹时长<2小时的样本, 共得到有效样本30例。
样品采集过程: 受试者呼出气在同一房间采集, 受试者休息30分钟后, 将冷凝管、5L的Tedlar袋、一次性吹嘴连接, 吹气直到充满Tedlar袋。收集完成后, 立即将Tedlar袋与3cm长的碱石棉管(吸收CO 2 )和苏玛罐相连接, 将呼出气转移到苏玛罐中; 记录受试者基本信息; 病患受试者还需用咽拭子采集上呼吸道分泌物, 用无菌棉签刮擦咽侧壁及咽后壁, 采集后的咽拭子用于细菌检测。
检测项目及方法: 从某三甲医院发热门诊获得上呼吸道感染病患血检指标, 包括白细胞数、中性粒细胞百分比; 用恒温扩增芯片法对病患呼吸道分泌物中13种常见致病菌(肺炎链球菌、金黄色葡萄球菌、大肠埃希氏菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、嗜麦芽窄食单胞菌、流感嗜血杆菌、嗜肺军团菌、肺炎支原体、肺炎衣原体、耐甲氧西林葡萄球菌、结核分支杆菌复合群)进行多通道芯片检测; 用GC-MS/FID 分析系统定量检测97种VOCs。
为保证冷凝效果, 每采3个样本对冷凝管进行一次清洗晾干, 每天采集一个室内空气样本作为本底对照。所有样本均在48小时内完成检测, GC-MS分析测定的质量控制和保证措施包括质谱调谐、系统标定和日校准。Liu 等 [28] 对比过本研究系统与台湾中央研究院环境变化研究中心的实验室检测结果, 相同样品的50多种 VOCs 中, 绝大多数偏差都在20%以内, 说明测量方法稳定可靠。
病患样本共60例, 根据引发上感的病因不同, 分为细菌组和非细菌组, 其中细菌组根据检测方法分为芯片–细菌组和血常规–细菌组。芯片–细菌组: 多通道芯片检测结果(1种或多种细菌)为阳性的病患; 血常规–细菌组: 研究表明, 上呼吸道细菌感染病患的白细胞数和中性粒细胞百分比均明显升高, 可能是细菌引起的炎症反应所致 [29] , 因此将芯片检测结果为阴性、血检结果白细胞值高于1.0×10 10 L − 1 且中性粒细胞百分数高于70%的病患定义为血常规–细菌组; 非细菌组: 芯片检测结果为阴性, 同时血检结果白细胞值低于1.0×10 10 L − 1 或中性粒细胞百分数低于70%定义为非细菌组。
为了展示不同人群呼出气VOCs浓度水平和分布情况, 并对比各组间差异, 所测得的VOC数据利用Shapiro-Wilk方法检验正态分布。对服从正态分布的VOCs, 利用ANOVA分析化合物在各组之间的差异; 对不服从正态分布的物种, 做对数变换后再进行ANOVA分析; 对数变换后仍不服从正态分布的物种, 用Kruskal-Wallis法进行非参数检验, 显著性检验所得 P 值小于0.05则表示差异显著。为了将复杂的呼出气VOCs组成简单化, 提高研究效率, 利用主成分分析(PCA)方法, 在保证丢失信息最少的原则下, 对原始数据做降维处理。研究表明, 当 n ≥ m +50( n 为样品数, m 为每个样品检测的VOCs化合物数)时, 可以得到稳定的PCA结果 [30] 。本研究筛选出人体呼出气中35种主要化合物进行主成分分析, 对数据进行KMO检验和Barlett球形检验, KMO=0.70, Bartlett球形检验统计量的Sig=0.00, 按照特征值大于1的提取原则(Kaiser原则), 得到8个因子, 累计解释方差为79.51%, 表明提取出了主要信息, 提取的公因子方差在0.53~0.97之间, 数据分布较均匀, 因此本研究的PCA分析结果是可信的。
研究表明, 人体呼出气中含上千种VOCs, 随着样本量增加, 人体呼出气中共性VOCs种类下降, 并趋于稳定, 当样本量>30, 共性VOCs数量基本上不变 [31] 。本研究共得到上呼吸道感染患者呼出气样本60例, 其中细菌组29例(包括芯片–细菌组12例、血常规–细菌组17例), 非细菌组31例, 健康人呼出气样本30例, 受试者基本信息统计情况如表1。
Shapiro-Wilk检验结果显示, 病患的年龄、体温、病程、空腹时长、白细胞数、中性粒细胞百分数均符合正态分布, 病患基本上处于青年阶段, 发热明显, 体温在38ºC以上, 病程多数在2~4天, 各组性别比例基本上均衡, 采样之前受试者空腹时长3~5小时; 健康人同样处于青年阶段, 男女比例接近1:1, 空腹时长均大于2小时。ANOVA分析结果显示, 细菌组和非细菌组人群年龄、体温、病程、空腹时长无统计学差异( P >0.05), 具有可比性, 其中芯片–细菌组检出细菌有流感嗜血杆菌(7例)、嗜麦芽窄食单胞菌(1例)、金黄色葡萄球菌(1例)、铜绿假单胞菌(2例)和耐甲氧西林葡萄球菌(1例)。
以往对呼出气VOCs的研究中, 化合物种类在10~40 范围居多, 也有少数研究的物种数达到 100以上。为了更全面地认识不同健康状态人体呼出气中 VOCs, 本研究共定量检测人体呼出气中97种VOCs, 根据官能团的不同, 可分为烷烃(27种)、烯烃(11种)、卤代烃(27种)、芳香烃(16种)、含氧烃(14种)和其他(2种: 乙腈、乙炔)共6类。病患与健康人呼出气中各类 VOCs 浓度水平如表 2 所示。与室内VOCs浓度对比可知, 人体呼出气中高浓度物种主要为含氧烃和烯烃, 其次是芳香烃和卤代烃, 烷烃类和其他类在人体呼出气中含量很低。人体呼出气总挥发性有机化合物(total volatile organic com- pounds, TVOC)显著高于室内空气水平( P <0.05), 病人呼出气中TVOC显著高于健康人( P <0.05)。
根据统计结果, 从单个化合物角度, 筛选出在各组间差异显著且检出率较高的VOCs, 结果见表3。多数物种在健康组与室内组间有差异, 且健康人呼出气普遍高于室内空气, 异戊烷、正己烷、异丁烷、间甲乙苯、丙烯、异丁烯醛、正丁醛、2-戊酮和对二氯苯在人体呼出气中浓度显著高于室内( P <0.05)。一些物种在病患与健康人组之间差异显著, 有的物种在病患组较高, 如正戊烷; 有的在健康组较高, 如异戊烷、二甲苯、间甲乙苯、正己烷、异丁烷和对二氯苯等; 只有异戊二烯在病患、健康人、室内空气均有显著差异( P <0.05), 且呈现出病患>健康人>室内的特点; 丙醛在细菌性上感组显著高于健康组( P =0.019)。
表1 病患及健康人基本信息
Table 1 Basic information of patients and healthy person

表2 病患、健康人呼出气与室内空气VOCs浓度水平(μg/m 3 )
Table 2 VOCs concentration among patients, health breath and indoor air (μg/m 3 )
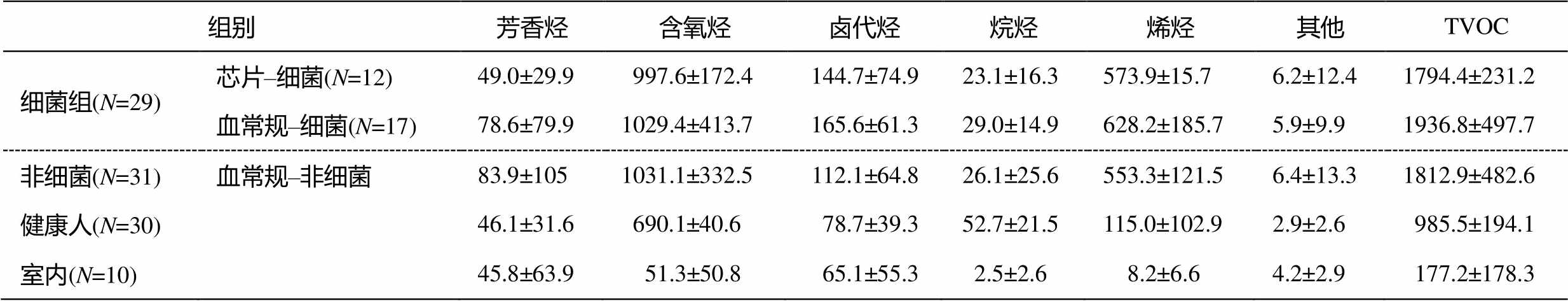
表3 病患、健康人呼出气与室内空气VOCs差异(μg/m 3 )
Table 3 Differences of VOCs concentration among patients、health breath and indoor air (μg/m 3 )
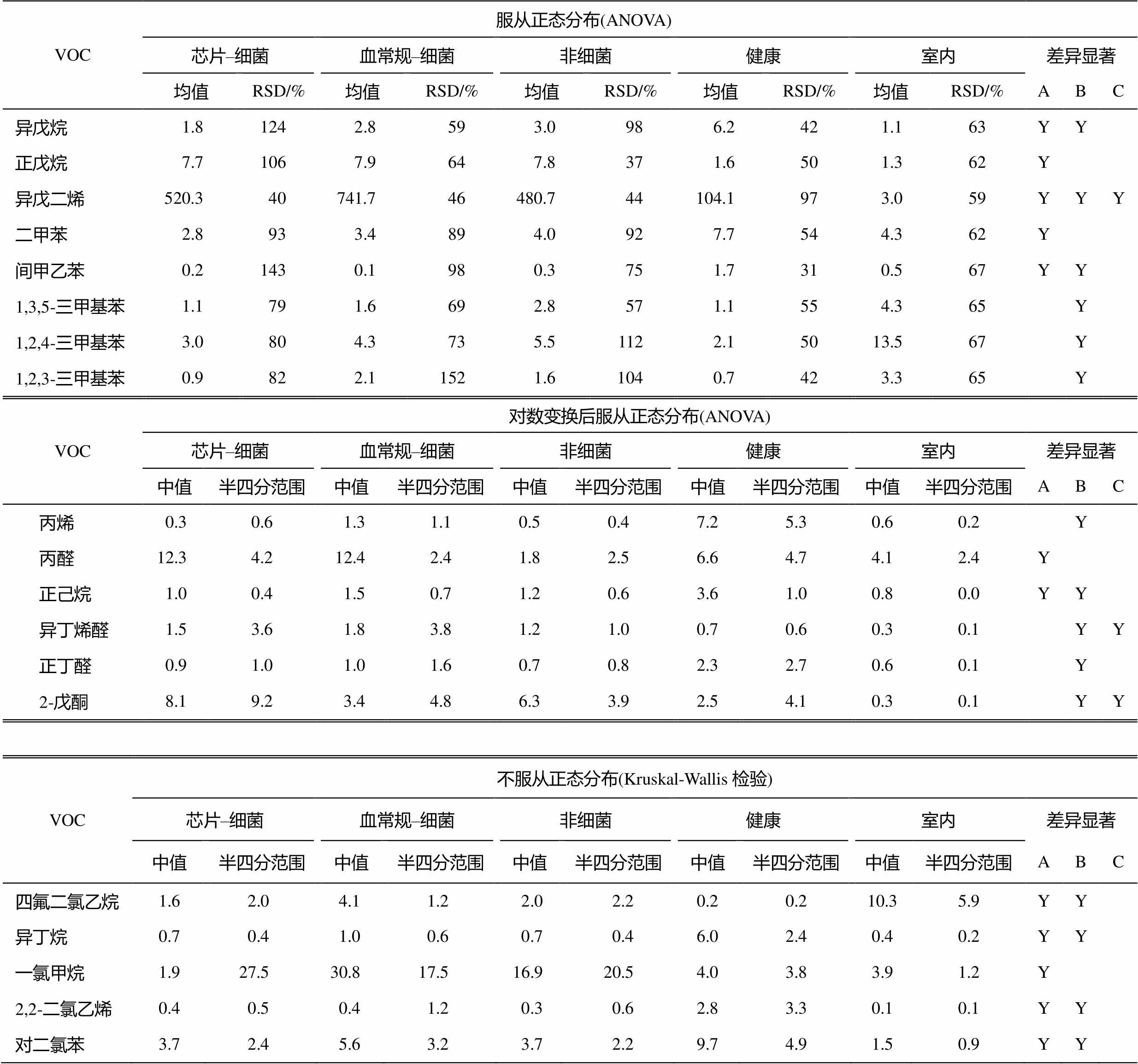
说明: A 表示病患与健康组间差异显著( P <0.05); B 表示健康人与室内空气组间差异显著( P <0.05); C 表示病患与室内空气组间差异显著( P <0.05)。差异显著评价标准: ANOVA单因素方差分析和事后检验, P <0.05; Kruskal-Wallis检验, P <0.05。
用 PCA 方法解析得到8个主因子, 累计解释方差为79.51%, VOCs化合物在主因子上的载荷见表4。载荷较高(>0.7)的物种中, 卤代烃有一氟三氯甲烷和1,2二氯乙烷, 含氧烃有戊醛和丁酮, 芳香烃有苯、甲苯、乙苯和二甲苯, 烯烃有丙烯和苯乙烯, 烷烃有异丁烷和正十一烷。
表4 PCA分析的35种VOCs成分载荷
Table 4 PCA loading components obtained on 35 investigated VOCs

说明: 只列出成分载荷绝对值在0.46以上的数据。
为了找出能够区分病患、健康人的因子, 用ANOVA 分析人体呼出气样本得分, 结果表明只有F2和 F4能够区分健康人和病患( P <0.05), 细菌性上感与非细菌性上感则差异不显著, 如图1所示。在F2上载荷较高的物种是异戊二烯、正己烷、正十一烷、正辛烷、二甲苯、乙苯、己醛、异丁烷、丙烯和3-甲基戊烷, 在 F4上载荷较高的物种是丁烯酮、异丁烯醛、二氟一氯甲烷和四氟二氯乙烷。
人体呼出气中VOCs来自人体的代谢过程, 实验数据显示, 人体呼出气中TVOC显著高于室内(表2), 主要体现在人体呼出气中含有较高浓度的含氧烃和烯烃。尤其是异戊二烯, 在健康人呼出气中浓度是室内浓度的几十倍, 在上感病患呼出气中浓度是健康人的4~7倍。
异戊二烯是人体呼出气中主要物质(表3), 有研究显示, 异戊二烯在健康人体内浓度水平在67~821 μg/m 3 之间 [32–35] 。本研究中健康人异戊二烯为104.1μg/m 3 , 与以往研究结果一致; 上感病人的异戊二烯为480.7~741.7μg/m 3 。以往针对呼出气中异戊二烯的多数研究表明异戊二烯与人体细胞的损伤有关。Foster 等 [36] 发现, 暴露在臭氧下19小时后, 伴随着皮肤修复作用的发生, 异戊二烯浓度升高, 说明异戊二烯与细胞的损伤和修复相关。其他类似的研究表明, 异戊二烯可以作为细胞损伤和细胞修复的标识物 [36–39] 。还有研究发现, 血液透析后病人呼出气中异戊二烯浓度会升高 [40] , 囊胞性纤维症病人在病情恶化期间伴随呼出气中异戊二烯浓度上升 [41] , 可能是膜修复功能损伤所致。此外, 异戊二烯也被认为可能是肺癌标志物 [42] 。本研究中, 与健康组相比,异戊二烯在上感组显著升高, 但细菌感染组与非细菌感染组没有显著差异(表3), 原因可能是伴随着人体上呼吸道的细菌感染或病毒感染, 引起细胞损伤及修复过程, 导致呼出气中异戊二烯显著升高。
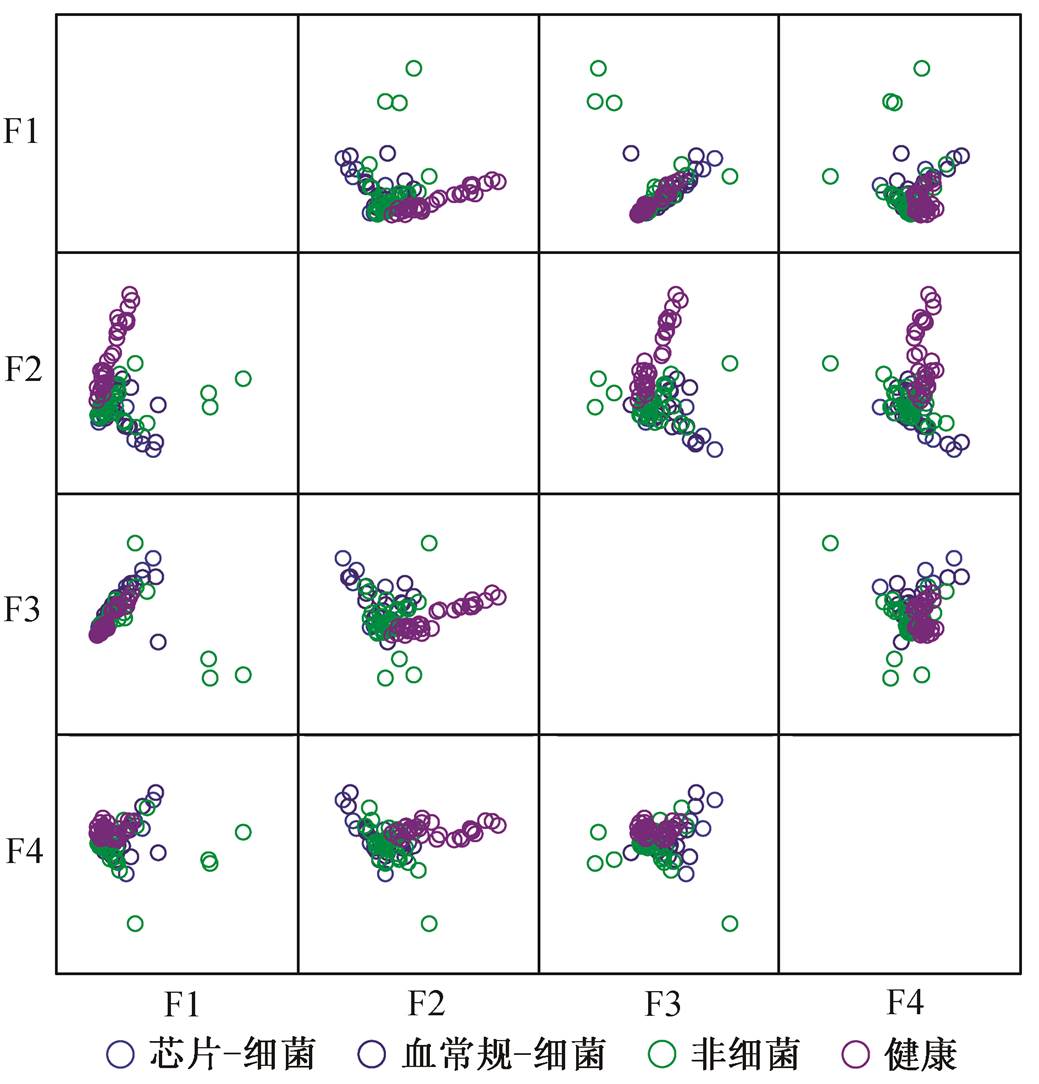
图1 PCA得分
Fig. 1 Principal component analysis score plot
烷烃类物质在上感组与健康组之间也存在明显差异, 多数烷烃类物质在上感组浓度低于健康组(表3), 如异戊烷、正己烷和异丁烷等( P <0.05), 但正戊烷在病患组浓度显著高于健康人( P <0.05)。研究表明, 人体内脂质过氧化反应与呼出气中正戊烷有关, 烷烃类物质是脂质过氧化最终产物, 且在血液中溶解度很低, 因此逸出到呼出气中, 可用来监测人体过氧化损伤的程度 [43–45] 。在上呼吸道感染状态下, 人体处于过氧化损伤状态, 可能导致呼出气中正戊烷明显高于健康人。
丙醛在细菌性上感病人呼出气中浓度显著高于健康组(表3)。关于呼出气中醛类物质的多数研究表明其与体内过氧化应激过程有关。酮体是机体在糖供能不足的情况下, 脂肪分解供能, 脂肪酸在肝脏中代谢产生的 [46] , 醛类则是与人体内过氧化应激反应相关的物质, 在肺癌患者呼出气中浓度高于健康人, 可以作为过氧化应激的标志物 [46–49] , 细菌性上感患者体内丙醛浓度约是健康人的2倍。细菌性上感的发病机理是, 当人体免疫力下降时, 上呼吸道原有的细菌可侵入黏膜细胞, 引起炎症反应 [50] , 导致中性粒细胞炎性浸润, 产生大量氧化中间产物。氧化应激过程中产生醛类物质, 这可能是丙醛在细菌性上感病人呼出气中浓度水平上升的原因。
无论从TVOC或单个化合物的比较分析, 还是通过PCA解析出的因子分析(表2~4), 都可以观察到人体呼出气与室内空气之间的差异以及健康人与上感病患之间的差异, 但细菌性上感与非细菌性上感之间的差异不显著, 希望未来能通过更广泛的物种检测、更大范围的采样来寻找上感分型病患呼出气中VOCs的差异。
本研究采集了90例人体呼出气样本, 其中上呼吸道感染病患60例, 健康人30例, 根据健康状态及检测结果, 分为芯片–细菌组( N =12)、血常规–细菌组( N =17)、血常规–非细菌组( N =31)和健康组( N =30), 定量分析了呼出气中97种VOCs, 对比分析不同健康状态人群呼出气VOCs, 得到如下结论。
1) 人体呼出气TVOC显著高于室内空气水平( P <0.05), 病患呼出气中TVOC显著高于健康人( P <0.05), 不同类型病患之间无显著差异。
2) 异戊二烯在病患组、健康组、室内空气间均有显著差异( P <0.05), 且呈现病患>健康人>室内的特点; 正戊烷在病患组浓度显著高于健康组( P <0.05); 丙醛在细菌性上感组显著高于健康组( P =0.019)。这些差异可能与上感病人体内细胞损伤、脂质过氧化反应以及炎症反应等有关。
3) PCA分析结果显示, 健康人和上感病患呼出气VOC能够通过因子2和因子4得到明显区分( P <0.05), 但目前研究的物种无法区分细菌性与非细菌性上感。
参考文献
[1]Pauling L, Robinson A B, Teranishi R, et al. Quanti- tative analysis of urine vapor and breath by gas-liquid partition chromatography. Proc Nat Acad Sci, 1971, 68(10): 2374–2376
[2]Musaveloso K, Rarama E, Comeau F, et al. Epilepsy and the ketogenic diet: assessment of ketosis in child- ren using breath acetone. Pediatric Research, 2002, 52(3): 443–449
[3]陈珠英, 孙美秀, 龚智勇, 等. 2 型糖尿病患者呼吸丙酮影响因素分析. 生物化学与生物物理进展, 2015, 42(5): 483–490
[4]Phillips M, Cataneo R N, Saunders C, et al. Volatile biomarkers in the breath of women with breast cancer. Journal of Breath Research, 2010, 4(2): 152–157
[5]Li Jie, Peng Yulan, Liu Yong, et al. Investigation of potential breath biomarkers for the early diagnosis of breast cancer using gas chromatography-mass spec- trometry. Clinica Chimica Acta, 2014, 436: 59–67
[6]宋耕, 秦涛, 刘虎, 等. 早期肺癌患者呼气中痕量挥发性有机化合物的定量检测. 安徽医科大学学报, 2008, 43(3): 323–326
[7]孙筱, 杨旭东, 章沁, 等. 呼吸散发挥发性有机化合物的实验研究. 暖通空调, 2013, 43(12): 23–28
[8]Phillips M, Ahorki N, Austin J H, et al. Prediction of lung cancer using volatile biomarkers in breath. Cancer Biomarkers, 2007, 3(2): 95–109
[9]Bajtarevic A, Ager C, Pienz M, et al. Noninvasive detection of lung cancer by analysis of exhaled breath. BMC Cancer, 2009, 9(1): 348
[10]王乐, 王镝, 於锦, 等. 呼吸气体诊断肺癌的电子鼻研制及诊断模型的研究. 仪表技术与传感器, 2009(增刊1): 295–298
[11]徐凤娟. 肺癌呼吸诊断特征气体的研究[D]. 浙江: 浙江大学, 2008: 47–67
[12]胡燕婕. 肺癌呼气特征性 VOCs 的筛选及诊断价值研究[D]. 杭州: 浙江大学, 2010: 12–50
[13]王怡珊. 肺癌呼出气体标志物确定及电子鼻临床诊断方法研究[D]. 杭州: 浙江大学, 2012: 7–20
[14]於锦. 呼出气体及其冷凝物中肺癌标志物及其检测方法的研究[D]. 杭州: 浙江大学, 2011: 14–43
[15]邹莹畅. 基于呼出气体及其冷凝物检测的肺癌早期诊断方法及仪器研究[D]. 杭州: 浙江大学, 2016: 17–33
[16]林丽泉, 董浩, 王福园, 等. 呼气检测技术与设备的研究进展. 中国医疗设备, 2016, 31(2): 12–17
[17]余凯. 用于肺癌筛查的呼出气体检测电子鼻仪器模块化设计[D]. 杭州: 浙江大学, 2012: 1–96
[18]Van Geffen W H, Bruins M, Kerstjens H A. Diagno- sing viral and bacterial respiratory infections in acute COPD exacerbations by an electronic nose: a pilot study. Journal of Breath Research, 2016, 10(3): 2–6
[19]Phillips C O, Syed Y, Parthaláin N M, et al. Machine learning methods on exhaled volatile organic com-pounds for distinguishing COPD patients from healthy controls. Journal of Breath Research, 2012, 6(3): 1–9
[20]陈慧中, 陆权, 张梓荆, 等. 急性上呼吸道感染治疗中抗生素的合理应用. 中国医刊, 2002, 37(6): 4–8
[21]席韩旭, 武轶群, 张洋, 等. 北京市三级综合医院急性上呼吸道感染患者头孢菌素应用的流行病学分析. 中华疾病控制杂志, 2014, 18(9): 847–850
[22]罗翌, 李际强, 郑丹文. 急性上呼吸道感染病毒病原学调查及临床特征的分析. 中国中医药, 2010, 8(17): 178–181
[23]吕燕宁, 黄芳, 高志勇, 等. 北京地区 2009 年 5−12月急性上呼吸道感染病毒病原学调查. 中国卫生检查, 2010, 10(20): 2476–2479
[24]谢术明. 800例上呼吸道感染患儿抗生素使用情况分析. 医药导报, 2003, 22(1): 37–40
[25]杨剑敏, 叶辉, 张泓, 等. CRP 和 SAA 在儿童上呼吸道感染中的鉴别诊断价值. 检验医学, 2016, 31 (8): 679–680
[26]盛红玲, 姜元培, 马燕, 等. 血清降钙素原、超敏C反应蛋白及白细胞介素-6在小儿急性上呼吸道感染中的诊断价值. 国际检验医学杂志, 2016, 37(9): 1207–1209
[27]王剑, 曾庆红, 华香. 血清降钙素原与 C 反应蛋白和白细胞介素-18 诊断急性上呼吸道感染患儿的临床研究. 中华医院感染学杂志, 2014, 24(15): 3887–3889
[28]Liu Ying, Shao Min, Lu Sihua, et al. Volatile organic compound (VOC) measurements in the Pearl River Delta (PRD) region, China. Atmos Chem Phys, 2008, 8(6): 1531–1545
[29]韩宁, 王红霞, 张艳萍, 等. 细菌性上呼吸道感染和病毒性上呼吸道感染血常规检测对比分析. 吉林医学, 2014, 35(21): 4685–4687
[30]Thurston G D, Spengler J D. A quantitative assess- ment of source contributions to inhalable particulate matter pollution in metropolitan Boston. Atmospheric Environment, 1985, 19(1): 9–25
[31]Phillips M, Herrera J, Krishnan S, et al. Variation in volatile organic compounds in the breath of normal humans. Journal of Chromatography B, 1999, 729 (1/2): 75–88
[32]Mendis S, Sobotka P A, Euler D E. Pentane and isoprene in expired air from humans: gas-chromato- graphic analysis of single breath. Clinical Chemistry, 1994, 40(8): 1485–1488
[33]Španěl P, Davies S, Smith D. Quantification of breath isoprene using the selected ion flow tube mass spec- trometric analytical method. Rapid Commun Mass Sp, 1999, 13(17): 1733–1738
[34]Turner C, Spanel P, Smith D. A longitudinal study of breath isoprene in healthy volunteers using selected ion flow tube mass spectrometry (SIFT-MS). Physiol Meas, 2005, 27(1): 13–22
[35]Enderby B, Lenney W, Brady M, et al. Concentrations of some metabolites in the breath of healthy children aged 7−18 years measured using selected ion flow tube mass spectrometry (SIFT-MS). J Breath Res, 2009, 3(3): 036001
[36]Foster W M, Jiang L, Stetkiewicz P T, et al. Breath isoprene: Temporal changes in respiratory output after exposure to ozone. Journal of Applied Physiology, 1996, 80(2): 706–710
[37]Trovarelli G, Brunori F, Medio G E D, et al. Onset, time course, and persistence of increased haemodia- lysis-induced breath isoprene emission. Nephron, 2001, 88(1): 44–47
[38]Davies S, Spanel P, Smith D. A new ‘online’ method to measure increased exhaled isoprene in end-stage renal failure. Nephrology Dialysis Transplantation, 2001, 16(4): 836–839
[39]Capodicasa E, Trovarelli G, De Medio G E, et al. Volatile alkanes and increased concentrations of isoprene in exhaled air during hemodialysis. Nephron, 1999, 82(4): 331–337
[40]Capodicasa E, Trovarelli G, Brunori F, et al. Lack of isoprene overproduction during peritoneal dialysis. Peritoneal Dialysis International, 2002, 22(1): 48–52
[41]Mcgrath L T, Patrick R, Mallon P, et al. Breath iso- prene during acute respiratory exacerbation in cystic fibrosis. European Respiratory Journal, 2000, 16(6): 1065–1069
[42]Phillips M, Gleeson K, Hughes J M B, et al. Volatile organic compounds in breath as markers of lung cancer: a cross-sectional study. Lancet, 1999, 353: 1930–1933
[43]Risby T H, Sehnert S S. Clinical application of breath biomarkers of oxidative stress status. Free Radical Biology and Medicine, 1999, 27(11/12): 1182–1192
[44]Kohlmuller D, Kochen W. Is n -pentane really an index of lipid-peroxidation in humans and animals? A methodological reevaluation. Analytical Biochemistry, 1993, 210(2): 268–276
[45]Miekisch W, Schubert J K, Noeldge-Schomburg G F E, et al. Diagnostic potential of breath analysis —focus on volatile organic compounds. Clinica Chimica Acta, 2004, 347(1/2): 25–39
[46]Musa-Veloso K, Likhodii S S, Rarama E, et al. Breath acetone predicts plasma ketone bodies in children with epilepsy on a ketogenic diet. Nutrition, 2006, 22(1): 1–8
[47]Song G, Qin T, Liu H, et al. Quantitative breath analysis of volatile organic compounds of lung cancer patients. Lung Cancer, 2010, 67(2): 227–231
[48]Poli D, Goldoni M, Corradi M, et al. Determination of aldehydes in exhaled breath of patients with lung cancer by means of on-fiber-derivatisation SPME-GC/MS. J Chromatogr B: Analyt Technol Biomed Life Sci, 2010, 878(27): 2643–2651
[49]Mlakar A, Spiteller G. Reinvestigation of lipid per- oxidation of linolenic acid. BBA Lipid Metab, 1994, 1214(2): 209–220
[50]游红霞. 上呼吸道感染发病机理及诊断. 临床研究, 2008, 5(8): 1293
Differences in Exhaled VOCs from Patients with Upper Respiratory Tract Infection and Healthy Ones
WANG Jue 1 , ZHENG Yunhao 1 , LIU Zhaorong 1,† , YAO Maosheng 1 , LI Xiaoguang 2 , ZHUANG Jia 1 , PENG Wangyuan 1
1. College of Environmental Science and Engineering, Peking University, Beijing 100871; 2. Department of Infectious Diseases, Peking University Third Hospital, Beijing 100191
Abstract Analysis of exhaled VOCs from health and patients may help building association between VOCs and different diseases condition, which could offer a possibility of noninvasive monitoring of disease. VOCs were collected in 30 healthy subjects and 60 patients with upper respiratory tract infection. Analysis of 97 VOCs was performed by gas chromatography and mass spectrometry (GC-MS). The concentration of alkanes, alkenes, halogenated hydrocarbon, oxygenated hydrocarbons and aromatic hydrocarbons in health and patients breath was analyzed. Analysis of variance (ANOVA), principal component analysis (PCA) were used to analyze the VOC differences from patients and healthy ones. The results show that the concentration of isoprene differ among patients, healthy ones and indoor air ( P <0.05). Patients show higher concentration of n -pentane compared to healthy ones ( P <0.05). Patients with bacterial upper respiratory tract infection show higher concentration of propanal compared to healthy ones. The results of PCA show that there were significant VOC differences between patients with upper respiratory tract infection and healthy ones ( P =0.019), but no differences between bacterial and non-bacterial upper respiratory tract infection.
Key words exhaled VOCs; upper respiratory tract infection; healthy; ANOVA-PCA
doi: 10.13209/j.0479-8023.2017.191
中图分类号 X132; R562
收稿日期: 2017-04-10;
修回日期: 2017-04-27;
网络出版日期: 2018-06-27
†通信作者 , E-mail: zrliu@pku.edu.cn
† Corresponding author , E-mail: zrliu@pku.edu.cn
国家重点基础研究发展计划(2016YFC0207102)资助